Khái quát về nhóm Halogen
Khái quát về nhóm Halogen
|
-Lớp 10
+ Lớp 11 |
I. NHÓM HALOGEN TRONG BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ
- Vị trí các halogen: Nhóm VIIA, cuối chu kì, ngay trước khí hiếm
- Gồm: Flo ( F), Clo ( Cl), Brom ( Br), Iot ( I), Atatin ( At)
- Trong đó, atatin là nguyên tố phóng xạ, không gặp trong thiên nhiên, được nghiên cứu trong nhóm các nguyên tố phóng xạ.
II. CẤU HÌNH ELECTRON NGUYÊN TỬ VÀ CẤU TẠO PHÂN TỬ CỦA CÁC NGUYÊN TỐ TRONG NHÓM HALOGEN
Đặc điểm cấu tạo chung của các nguyên tố Halogen?
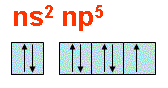
1. Cấu hình electron:
Từ vị trí của các nguyên tố Halogen, cho biết số electron lớp ngoài cùng ? cấu hình electron lớp ngoài cùng của chúng?
( n là số thứ tự lớp ngoài cùng)
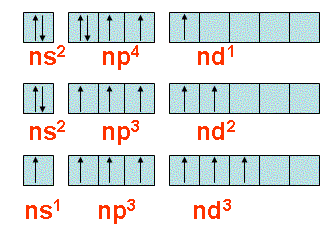
Từ sự phân bố electron vào obitan, cho biết số electron độc thân của các nguyên tố halogen ở trạng thái cơ bản và kích thích?
2. Cấu tạo phân tử
– Đơn chất halogen: gồm 2 nguyên tử liên kết bằng liên kết cộng hoá trị tạo thành phân tử X2
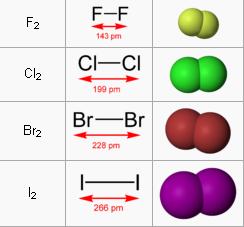
- Năng lượng liên kết X-X của phân tử X2 không lớn ( từ 151 đến 243 kJ/mol) nên các phân tử halogen tương đối dễ tách thành hai nguyên tử.
III. Khái quát về tính chất của các halogen
1. Tính chất vật lí:
Từ hình ảnh các halogen ở trên, cho biết trạng thái và màu sắc của chúng? Có nhận xét gì về sự biến đổi màu sắc, trạng thái của chúng từ flo đến iot?
2. Tính chất hoá học
Từ cấu hình e, dự đoán tính chất hoá học của các halogen? Giống nhau? Khác nhau?
- Vì lớp ngoài cùng có cấu hình tương tự nhau nên các halogen có nhiều điểm giống nhau về tính chất hoá học của đơn chất cũng như thành phần và tính chất của các hợp chất.
- Các halogen có độ âm điện lớn. Độ âm điện của flo (3,98 ) là lớn nhất trong tất cả các nguyên tố hoá học.
- Từ flo đến iot, bán kính nguyên tử tăng dần và độ âm điện giảm dần. ( Giải thích?)
Tính chất hoá học cơ bản của các halogen?
- Halogen là những phi kim điển hình, chúng là những chất oxi hoá mạnh.
So sánh khả năng oxi hoá của các halogen?
- Tính oxi hoá của các halogen giảm dần từ flo đến iot. (giải thích?)
Các em hãy trả lời các câu hỏi sau:
Câu 1: Tại sao các nguyên tố nhóm VIIA có tên gọi là halogen?
Câu 2: Tại sao clo, brom, iot có các số oxi hoá -1, +1, +3, +5,+7. Còn flo chỉ có số oxi hoá -1?
Câu 3: Các halogen giống nhau như thế nào về tính chất hoá học? giải thích?
Câu 4: Từ flo đến iot, tính chất hoá học của các nguyên tố biến đổi như thế nào? giải thích?
Câu 5: Nguyên tố nào có độ âm điện lớn nhất trong tất cả các nguyên tố trong bảng HTTH?
|
Subscribe to:
Post Comments (Atom)


 Trang Trước
Trang Trước






No comments: