VIẾT PHƯƠNG TRÌNH HOÁ HỌC
CHUYÊN ĐỀ 1: VIẾT PHƯƠNG TRÌNH HOÁ HỌC
I/ Phản ứng vừa có sự thay đổi số oxi hoá, vừa không có sự thay đổi số oxi hoá.
1/ Phản ứng hoá hợp.
- Đặc điểm của phản ứng: Có thể xảy ra sự thay đổi số oxi hoá hoặc không.
Ví dụ:
Phản ứng có sự thay đổi số oxi hoá.
4Al (r) + 3O2 (k) ----> 2Al2O3 (r)
Phản ứng không có sự thay đổi số oxi hoá.
BaO (r) + H2O (l) ----> Ba(OH)2 (dd)
2/ Phản ứng phân huỷ.
- Đặc điểm của phản ứng: Có thể xảy ra sự thay đổi số oxi hoá hoặc không.
Ví dụ:
Phản ứng có sự thay đổi số oxi hoá.
2KClO3 (r) -------> 2KCl (r) + 3O2 (k)
Phản ứng không có sự thay đổi số oxi hoá.
CaCO3 (r) -----> CaO (r) + CO2 (k)
II/ Phản ứng có sự thay đổi số oxi hoá.
1/ Phản ứng thế.
- Đặc điểm của phản ứng: Nguyên tử của đơn chất thay thế một hay nhiều nguyên tử của một nguyên tố trong hợp chất.
Ví dụ:
Zn (r) + 2HCl (dd) ----> ZnCl2 (dd) + H2 (k)
2/ Phản ứng oxi hoá - khử.
- Đặc điểm của phản ứng: Xảy ra đồng thời sự oxi hoá và sự khử. hay xảy ra đồng thời sự nhường electron và sự nhận electron.
Ví dụ:
CuO (r) + H2 (k) ------> Cu (r) + H2O (h)
Trong đó:
- H2 là chất khử (Chất nhường e cho chất khác)
- CuO là chất oxi hoá (Chất nhận e của chất khác)
- Từ H2 -----> H2O được gọi là sự oxi hoá. (Sự chiếm oxi của chất khác)
- Từ CuO ----> Cu được gọi là sự khử. (Sự nhường oxi cho chất khác)
III/ Phản ứng không có thay đổi số oxi hoá.
1/ Phản ứng giữa axit và bazơ.
- Đặc điểm của phản ứng: Sản phẩm thu được là muối và nước.
Ví dụ:
2NaOH (dd) + H2SO4 (dd) ----> Na2SO4 (dd) + 2H2O (l)
NaOH (dd) + H2SO4 (dd) ----> NaHSO4 (dd) + H2O (l)
Cu(OH)2 (r) + 2HCl (dd) ----> CuCl2 (dd) + 2H2O (l)
Trong đó:
Phản ứng trung hoà (2 chất tham gia ở trạng thái dung dịch).
- Đặc điểm của phản ứng: là sự tác dụng giữa axit và bazơ với lượng vừa đủ.
- Sản phẩm của phản ứng là muối trung hoà và nước.
Ví dụ:
NaOH (dd) + HCl (dd) ----> NaCl (dd) + H2O (l)
2/ Phản ứng gữa axit và muối.
- Đặc điểm của phản ứng: Sản phẩm thu được phải có ít nhất một chất không tan hoặc một chất khí hoặc một chất điện li yếu.
Ví dụ:
Na2CO3 (r) + 2HCl (dd) ----> 2NaCl (dd) + H2O (l) + CO2 (k)
BaCl2 (dd) + H2SO4 (dd) -----> BaSO4 (r) + 2HCl (dd)
Lưu ý: BaSO4 là chất không tan kể cả trong môi trường axit.
3/ Phản ứng giữa bazơ và muối.
- Đặc điểm của phản ứng:
+ Chất tham gia phải ở trạng thái dung dịch (tan được trong nước)
+ Chất tạo thành (Sản phẩm thu được) phải có ít nhất một chất không tan hoặc một chất khí hoặc một chất điện li yếu.
+ Chú ý các muối kim loại mà oxit hay hiđroxit có tính chất lưỡng tính phản ứng với dung dịch bazơ mạnh.
Ví dụ:
2NaOH (dd) + CuCl2 (dd) ----> 2NaCl (dd) + Cu(OH)2 (r)
Ba(OH)2 (dd) + Na2SO4 (dd) ---> BaSO4 (r) + 2NaOH (dd)
NH4Cl (dd) + NaOH (dd) ---> NaCl (dd) + NH3 (k) + H2O (l)
AlCl3 (dd) + 3NaOH (dd) ----> 3NaCl (dd) + Al(OH)3 (r)
Al(OH)3 (r) + NaOH (dd) ---> NaAlO2 (dd) + H2O (l)
4/ Phản ứng giữa 2 muối với nhau.
- Đặc điểm của phản ứng:
+ Chất tham gia phải ở trạng thái dung dịch (tan được trong nước)
+ Chất tạo thành (Sản phẩm thu được) phải có ít nhất một chất không tan hoặc một chất khí hoặc một chất điện li yếu.
Ví dụ:
NaCl (dd) + AgNO3 (dd) ----> AgCl (r) + NaNO3 (dd)
BaCl2 (dd) + Na2SO4 (dd) ----> BaSO4 (r) + 2NaCl (dd)
2FeCl3 (dd) + 3H2O (l) + 3Na2CO3 (dd) ----> 2Fe(OH)3 (r) + 3CO2 (k) + 6NaCl (dd)
CÁC PHƯƠNG PHÁP CÂN BẰNG MỘT PHƯƠNG TRÌNH PHẢN ỨNG.
1/ Cân bằng phương trình theo phương pháp đại số.
Ví dụ: Cân bằng phương trình phản ứng
P2O5 + H2O -> H3PO4
Đưa các hệ số x, y, z vào phương trình ta có:
- Căn cứ vào số nguyên tử P ta có: 2x = z (1)
- Căn cứ vào số nguyên tử O ta có: 5x + y = z (2)
- Căn cứ vào số nguyên tử H ta có: 2y = 3z (3)
Thay (1) vào (3) ta có: 2y = 3z = 6x => y =  = 3x
= 3x
Nếu x = 1 thì y = 3 và z = 2x = 2.1 = 2
=> Phương trình ở dạng cân bằng như sau: P2O5 + 3H2O -> 2H3PO4
Ví dụ: Cân bằng phương trình phản ứng.
Al + HNO3 (loãng) ----> Al(NO3)3 + NO + H2O
Bước 1: Đặt hệ số bằng các ẩn số a, b, c, d trước các chất tham gia và chất tạo thành (Nếu 2 chất mà trùng nhau thì dùng 1 ẩn)
Ta có.
a Al + b HNO3 ----> a Al(NO3)3 + c NO + b/2 H2O.
Bước 2: Lập phương trình toán học với từng loại nguyên tố có sự thay đổi về số nguyên tử ở 2 vế.
Ta nhận thấy chỉ có N và O là có sự thay đổi.
N: b = 3a + c (I)
O: 3b = 9a + c + b/2 (II)
Bước 3: Giải phương trình toán học để tìm hệ số
Thay (I) vào (II) ta được.
3(3a + c) = 9a + c + b/2
2c = b/2 ----> b = 4c ---> b = 4 và c = 1. Thay vào (I) ---> a = 1.
Bước 4: Thay hệ số vừa tìm được vào phương trình và hoàn thành phương trình.
Al + 4 HNO3 ----> Al(NO3)3 + NO + 2 H2O
Bước 5: Kiểm tra lại phương trình vừa hoàn thành.
2/ Cân bằng theo phương pháp electron.
Ví dụ:
Cu + HNO3 (đặc) -----> Cu(NO3)2 + NO2 + H2O
Bước 1: Viết PTPƯ để xác định sự thay đổi số oxi hoá của nguyên tố.
Ban đầu: Cu0 ----> Cu+ 2 Trong chất sau phản ứng Cu(NO3)2
Ban đầu: N+ 5 (HNO3) ----> N+ 4 Trong chất sau phản ứng NO2
Bước 2: Xác định số oxi hoá của các nguyên tố thay đổi.
Cu0 ----> Cu+ 2
N+ 5 ----> N+ 4
Bước 3: Viết các quá trình oxi hoá và quá trình khử.
Cu0 – 2e ----> Cu+ 2
N+ 5 + 1e ----> N+ 4
Bước 4: Tìm bội chung để cân bằng số oxi hoá.
2 N+ 5 + 1e ----> N+ 4
Bước 5: Đưa hệ số vào phương trình, kiểm tra, cân bằng phần không oxi hoá - khử và hoàn thành PTHH.
Cu + 2HNO3 (đặc) -----> Cu(NO3)2 + 2NO2 + H2O
+ 2HNO3 (đặc) ----->
 Cu + 4HNO3 (đặc) -----> Cu(NO3)2 + 2NO2 + 2H2O
Cu + 4HNO3 (đặc) -----> Cu(NO3)2 + 2NO2 + 2H2O
3/ Cân bằng theo phương pháp bán phản ứng ( Hay ion – electron)
Theo phương pháp này thì các bước 1 và 2 giống như phương pháp electron.
Bước 3: Viết các bán phản ứng oxi hoá và bán phản ứng khử theo nguyên tắc:
+ Các dạng oxi hoá và dạng khử của các chất oxi hoá, chất khử nếu thuộc chất điện li mạnh thì viết dưới dạng ion. Còn chất điện li yếu, không điện li, chất rắn, chất khí thì viết dưới dạng phân tử (hoặc nguyên tử). Đối với bán phản ứng oxi hoá thì viết số e nhận bên trái còn bán phản ứng thì viết số e cho bên phải.
Bước 4: Cân bằng số e cho – nhận và cộng hai bán phản ứng ta được phương trình phản ứng dạng ion.
Muốn chuyển phương trình phản ứng dạng ion thành dạng phân tử ta cộng 2 vế những lượng tương đương như nhau ion trái dấu (Cation và anion) để bù trừ điện tích.
Chú ý: cân bằng khối lượng của nửa phản ứng.
Môi trường axit hoặc trung tính thì lấy oxi trong H2O.
Bước 5: Hoàn thành phương trình.
MỘT SỐ PHẢN ỨNG HOÁ HỌC THÔNG DỤNG.
Cần nắm vững điều kiện để xảy ra phản ứng trao đổi trong dung dịch.
Gồm các phản ứng:
2/ Axit + Muối  Muối mới + Axít mới
Muối mới + Axít mới
3/ Dung dịch Muối + Dung dịch Bazơ  Muối mới + Bazơ mới
Muối mới + Bazơ mới
4/ 2 Dung dịch Muối tác dụng với nhau  2 Muối mới
2 Muối mới
Điều kiện để xảy ra phản ứng trao đổi là: Sản phẩm thu được phải có ít nhất một chất không tan hoặc một chất khí hoặc phải có H2O và các chất tham gia phải theo yêu cầu của từng phản ứng.
Tính tan của một số muối và bazơ.
- Hầu hết các muối clo rua đều tan ( trừ muối AgCl , PbCl2 )
- Tất cả các muối nit rat đều tan.
- Tất cả các muối của kim loại kiềm đều tan.
- Hầu hết các bazơ không tan ( trừ các bazơ của kim loại kiềm, Ba(OH)2 và Ca(OH)2 tan ít.
* Na2CO3 , NaHCO3 ( K2CO3 , KHCO3 ) và các muối cacbonat của Ca, Mg, Ba đều tác dụng được với a xít.
NaHCO3 + NaHSO4  Na2SO4 + H2O + CO2
Na2SO4 + H2O + CO2
NaHCO3 + Ba(OH)2  BaCO3 + NaOH + H2O
BaCO3 + NaOH + H2O
2NaHCO3 + 2KOH  Na2CO3 + K2CO3 + 2H2O
Na2CO3 + K2CO3 + 2H2O
Na2CO3 + Ba(OH)2  BaCO3 + 2NaOH
BaCO3 + 2NaOH
Ba(HCO3)2 + Ba(OH)2  2BaCO3 + 2H2O
2BaCO3 + 2H2O
Ca(HCO3)2 + Ba(OH)2  BaCO3 + CaCO3 + 2H2O
BaCO3 + CaCO3 + 2H2O
Ba(HCO3)2 + BaCl2  không xảy ra
không xảy ra
Ca(HCO3)2 + CaCl2  không xảy ra
không xảy ra
NaHSO3 + NaHSO4  Na2SO4 + H2O + SO2
Na2SO4 + H2O + SO2
Na2SO3 + H2SO4  Na2SO4 + H2O + SO2
Na2SO4 + H2O + SO2
2NaHSO3 + H2SO4  Na2SO4 + 2H2O + 2SO2
Na2SO4 + 2H2O + 2SO2
Na2SO3 + 2NaHSO4  2Na2SO4 + H2O + SO2
2Na2SO4 + H2O + SO2
2KOH + 2NaHSO4  Na2SO4 + K2SO4 + H2O
Na2SO4 + K2SO4 + H2O
(NH4)2CO3 + 2NaHSO4  Na2SO4 + (NH4)2SO4 + H2O + CO2
Na2SO4 + (NH4)2SO4 + H2O + CO2
Một số PTHH cần lưu ý:
Ví dụ: Hoà tan m( gam ) MxOy vào dung dịch axit (HCl, H2SO4, HNO3)
Ta có PTHH cân bằng như sau: lưu ý 2y/x là hoá trị của kim loại M
2MxOy + 2yH2SO4  xM2(SO4)2y/x + 2yH2O
xM2(SO4)2y/x + 2yH2O
MxOy + 2yHNO3  xM(NO3)2y/x + yH2O
xM(NO3)2y/x + yH2O
VD: Hoà tan m( gam ) kim loại M vào dung dịch a xit (HCl, H2SO4)
Ta có PTHH cân bằng như sau: lưu ý x là hoá trị của kim loại M
áp dụng:
6
áp dụng:
Các phản ứng điều chế một số kim loại:
· Đối với một số kim loại như Na, K, Ca, Mg thì dùng phương pháp điện phân nóng chảy các muối Clorua.
PTHH chung: 2MClx (r )  2M(r ) + Cl2( k )
2M(r ) + Cl2( k )
(đối với các kim loại hoá trị II thì nhớ đơn giản phần hệ số)
· Đối với nhôm thì dùng phương pháp điện phân nóng chảy Al2O3, khi có chất xúc tác Criolit(3NaF.AlF3) , PTHH: 2Al2O3 (r )  4Al ( r ) + 3 O2 (k )
4Al ( r ) + 3 O2 (k )
· Đối với các kim loại như Fe , Pb , Cu thì có thể dùng các phương pháp sau:
- Dùng H2: FexOy + yH2  xFe + yH2O ( h )
xFe + yH2O ( h )
- Dùng C: 2FexOy + yC(r )  2xFe + yCO2 ( k )
2xFe + yCO2 ( k )
- Dùng CO: FexOy + yCO (k )  xFe + yCO2 ( k )
xFe + yCO2 ( k )
- Dùng Al( nhiệt nhôm ): 3FexOy + 2yAl (r )  3xFe + yAl2O3 ( k )
3xFe + yAl2O3 ( k )
- PTPƯ nhiệt phân sắt hiđrô xit:
4xFe(OH)2y/x + (3x – 2y) O2  2xFe2O3 + 4y H2O
2xFe2O3 + 4y H2O
Một số phản ứng nhiệt phân của một số muối
1/ Muối nitrat
· Nếu M là kim loại đứng trước Mg (Theo dãy hoạt động hoá học)
(Với những kim loại hoá trị II thì nhớ đơn giản phần hệ số )
· Nếu M là kim loại kể từ Mg đến Cu (Theo dãy hoạt động hoá học)
(Với những kim loại hoá trị II thì nhớ đơn giản phần hệ số )
· Nếu M là kim loại đứng sau Cu (Theo dãy hoạt động hoá học)
(Với những kim loại hoá trị II thì nhớ đơn giản phần hệ số)
2/ Muối cacbonat
- Muối trung hoà: M2(CO3)x (r)  M2Ox (r) + xCO2(k)
M2Ox (r) + xCO2(k)
(Với những kim loại hoá trị II thì nhớ đơn giản phần hệ số)
- Muối cacbonat axit: 2M(HCO3)x(r)  M2(CO3)x(r) + xH2O( h ) + xCO2(k)
M2(CO3)x(r) + xH2O( h ) + xCO2(k)
(Với những kim loại hoá trị II thì nhớ đơn giản phần hệ số)
3/ Muối amoni
NH4HCO3  NH3 (k) + H2O ( h ) + CO2(k)
NH3 (k) + H2O ( h ) + CO2(k)
(NH4)2CO3  2NH3 (k) + H2O ( h ) + CO2(k)
2NH3 (k) + H2O ( h ) + CO2(k)
2(NH4)2SO4  4NH3 (k) + 2H2O ( h ) + 2SO2 ( k ) + O2(k)
4NH3 (k) + 2H2O ( h ) + 2SO2 ( k ) + O2(k)
Bài 1: Viết các phương trình hoá học biểu diễn các phản ứng hoá học ở các thí nghiệm sau:
a) Nhỏ vài giọt axit clohiđric vào đá vôi.
b) Hoà tan canxi oxit vào nước.
c) Cho một ít bột điphotpho pentaoxit vào dung dịch kali hiđrôxit.
d) Nhúng một thanh sắt vào dung dịch đồng(II) sunfat.
e) Cho một mẫu nhôm vào dung dịch axit sunfuric loãng.
f) Nung một ít sắt(III) hiđrôxit trong ống nghiệm.
g) Dẫn khí cacbonic vào dung dịch nước vôi trong đến dư.
h) Cho một ít natri kim loại vào nước.
Bài 2: Có những bazơ sau: Fe(OH)3, Ca(OH)2, KOH, Mg(OH)2. Hãy cho biết những bazơ nào:
a) Bị nhiệt phân huỷ?
b) Tác dụng được với dung dịch H2SO4?
c) Đổi màu dung dịch phenolphtalein từ không màu thành màu hồng?
Bài 3: Cho các chất sau: canxi oxit, khí sunfurơ, axit clohiđric, bari hiđrôxit, magiê cacbonat, bari clorua, điphotpho penta oxit. Chất nào tác dụng được với nhau từng đôi một. Hãy viết các phương trình hoá học của phản ứng.
Hướng dẫn: Lập bảng để thấy được các cặp chất tác dụng được với nhau rõ hơn.
Bài 4: Cho các oxit sau: K2O, SO2, BaO, Fe3O4, N2O5. Viết phương trình hoá học(nếu có) của các oxit này lần lượt tác dụng với nước, axit sunfuric, dung dịch kali hiđroxit.
Bài 5: Cho một lượng khí CO dư đi vào ống thuỷ tinh đốt nóng có chứa hỗn hợp bột gồm: CuO, K2O, Fe2O3 (đầu ống thuỷ tinh còn lại bị hàn kín). Viết tất cả các phương trình hoá học xảy ra.
Bài 6: Nêu hiện tượng và viết PTHH minh hoạ
a/ Cho Na vào dung dịch Al2(SO4)3
b/ Cho K vào dung dịch FeSO4
c/ Hoà tan Fe3O4 vào dung dịch H2SO4 loãng.
d/ Nung nóng Al với Fe2O3 tạo ra hỗn hợp Al2O3 và FexOy.
PTHH tổng quát:
3x Fe2O3 + ( 6x – 4y ) Al  6 FexOy + ( 3x – 2y ) Al2O3
6 FexOy + ( 3x – 2y ) Al2O3
Bài 7: Cho thí nghiệm
a. Hoàn thành các PTHH và xác định các khí A, B, C, D, E.
b. Cho A tác dụng C, B tác dụng với dung dịch A, B tác dung với C, A tác dung dịch NaOH ở điều kiện thường, E tác dụng dung dịch NaOH. Viết các PTHH xảy ra.
Bài 8: Nêu hiện tượng xảy ra, giải thích và viết PTHH minh hoạ khi:
1/ Sục từ từ đến dư CO2 vào dung dịch nước vôi trong; dung dịch NaAlO2.
2/ Cho từ từ dung dịch axit HCl vào dung dịch Na2CO3.
3/ Cho Na vào dung dịch MgCl2, NH4Cl.
4/ Cho Na vào dung dịch CuSO4, Cu(NO3)2.
5/ Cho Ba vào dung dịch Na2CO3, (NH4)2CO3, Na2SO4.
6/ Cho Fe vào dung dịch AgNO3 dư
7/ Cho từ từ đến dư dung dịch NaOH vào dung dịch AlCl3, Al2(SO4)3.
8/ Cho Cu ( hoặc Fe ) vào dung dịch FeCl3.
9/ Cho từ từ đến dư bột Fe vào hỗn hợp dung dịch gồm AgNO3 và Cu(NO3)2.
10/ Sục từ từ NH3 vào dung dịch AlCl3.
MỘT SỐ PHƯƠNG PHÁP GIẢI TOÁN HOÁ HỌC THÔNG DỤNG.
1. Phương pháp số học
Giải các phép tính Hoá học ở cấp II phổ thông, thông thường sử dụng phương pháp số học: Đó là các phép tính dựa vào sự phụ thuộc tỷ lệ giữa các đại lượng và các phép tính phần trăm. Cơ sở của các tính toán Hoá học là định luật thành phần không đổi được áp dụng cho các phép tính theo CTHH và định luật bảo toàn khối lượng các chất áp dụng cho cá phép tính theo PTHH. Trong phương pháp số học người ta phân biệt một số phương pháp tính sau đây:
a. Phương pháp tỉ lệ.
Điểm chủ yếu của phương pháp này là lập được tỉ lệ thức và sau đó là áp dụng cách tính toán theo tính chất của tỉ lệ thức tức là tính các trung tỉ bằng tích các ngoại tỉ.
Thí dụ: Tính khối lượng cácbon điôxit CO2 trong đó có 3 g cacbon.
Bài giải
1mol CO2 = 44g
Lập tỉ lệ thức: 44g CO2 có 12g C
xg 3g C
44 : x = 12 : 3
Vậy, khối lượng cacbon điôxit là 11g
Thí dụ 2: Có bao nhiêu gam đồng điều chế được khi cho tương tác 16g đồng sunfat với một lượng sắt cần thiết.
Bài giải
Phương trình Hoá học: CuSO4 + Fe - > FeSO4 + Cu
160g 64g
16g xg
Vậy điều chế được 6,4g đồng.
b. Phương pháp tính theo tỉ số hợp thức.
Dạng cơ bản của phép tính này tính theo PTHH tức là tìm khối lượng của một trong những chất tham gia hoặc tạo thành phản ứng theo khối lượng của một trong những chất khác nhau. Phương pháp tìm tỉ số hợp thức giữa khối lượng các chất trong phản ứng được phát biểu như sau:
"Tỉ số khối lượng các chất trong mỗi phản ứng Hoá học thì bằng tỉ số của tích các khối lượng mol các chất đó với các hệ số trong phương trình phản ứng". Có thể biểu thị dưới dạng toán học như sau:
Trong đó: m1 và m2 là khối lượng các chất, M1, M2 là khối lượng mol các chất còn n1, n2 là hệ số của PTHH.
Vậy khi tính khối lượng của một chất tham gia phản ứng Hoá học theo khối lượng của một chất khác cần sử dụng những tỉ số hợp thức đã tìm được theo PTHH như thế nào ? Để minh hoạ ta xét một số thí dụ sau:
Thí dụ 1: Cần bao nhiêu gam Pôtat ăn da cho phản ứng với 10g sắt III clorua ?
Bài giải
PTHH FeCL3 + 3KOH -> Fe(OH)3 + 3KCL
+ 3KCL
10g ?
Tính tỉ số hợp thức giữa khối lượng Kali hiđrôxit và sắt II clorua
MKOH = (39 + 16 + 1) = 56g
Thí dụ 2: Cần bao nhiêu gam sắt III chorua cho tương tác với kalihiđrôxit để thu được 2,5g Kaliclorua?
Bài giải
PTHH FeCl3 + 3 KOH - > Fe(OH)3 + 3KCl
+ 3KCl
Tính tỉ số hợp thức giữa khối lượng FeCl3 và Kaliclorua
c. Phương pháp tính theo thừa số hợp thức.
Hằng số được tính ra từ tỉ lệ hợp thức gọi là thừa số hợp thức và biểu thị bằng chữ cái f. Thừa số hợp thức đã được tính sẵn và có trong bảng tra cứu chuyên môn.
Việc tính theo thừa số hợp thức cũng cho cùng kết quả như phép tính theo tỉ số hợp thức nhưng được tính đơn giản hơn nhờ các bảng tra cứu có sẵn.
Thí dụ: Theo thí dụ 2 ở trên thì thừa số hợp thức là:
Vậy, khối lượng FeCl3 là 1,86g
2. Phương pháp đại số
Trong các phương pháp giải các bài toán Hoá học phương pháp đại số cũng thường được sử dụng. Phương pháp này có ưu điểm tiết kiệm được thời gian, khi giải các bài toán tổng hợp, tương đối khó giải bằng các phương pháp khác. Phương pháp đại số được dùng để giải các bài toán Hoá học sau:
a. Giải bài toán lập CTHH bằng phương pháp đại số.
Thí dụ: Đốt cháy một hỗn hợp 300ml hiđrocacbon và amoniac trong oxi có dư. Sau khi cháy hoàn toàn, thể tích khí thu được là 1250ml. Sau khi làm ngưng tụ hơi nước, thể tích giảm còn 550ml. Sau khi cho tác dụng với dung dịch kiềm còn 250ml trong đó có 100ml nitơ. Thể tích của tất cả các khí đo trong điều kiện như nhau. Lập công thức của hiđrocacbon
Bài giải
Khi đốt cháy hỗn hợp hiđrocacbon và amoniac trong oxi phản ứng xảy ra theo phương trình sau:
4NH3 + 3O2 -> 2N2 + 6H2O (1)
CxHy + (x +  O2 -> xCO2 +
O2 -> xCO2 +  H2O (2)
H2O (2)
Theo dữ kiện bài toán, sau khi đốt cháy amoniac thì tạo thành 100ml nitơ. Theo PTHH (1) sau khi đốt cháy hoàn toàn amoniac ta thu được thể tích nitơ nhỏ hơn 2 lần thể tích amoniac trong hỗn hợp ban đầu, vậy thể tích amonac khi chưa có phản ứng là 100. 2 = 200ml. Do đó thể tích hiđro cácbon khi chưa có phản ứng là 300 - 200 = 100ml. Sau khi đốt cháy hỗn hợp tạo thành (550 - 250) = 300ml, cacbonnic và (1250 - 550 - 300) = 400ml hơi nước.
Từ đó ta có sơ đồ phản ứng:
CxHy + (x +  ) O2 -> xCO2 +
) O2 -> xCO2 +  H2O
H2O
100ml 300ml 400ml
Theo định luật Avogađro, có thể thay thế tỉ lệ thể tích các chất khí tham gia và tạo thành trong phản ứng bằng tỉ lệ số phân tử hay số mol của chúng.
CxHy + 5O2 -> 3CO2 + 4 H2O
=> x = 3; y = 8
Vậy CTHH của hydrocacbon là C3H8
b. Giải bài toán tìm thành phần của hỗn hợp bằng phương pháp đại số.
Thí dụ: Hoà tan trong nước 0,325g một hỗn hợp gồm 2 muối Natriclorua và Kaliclorua. Thêm vào dung dịch này một dung dịch bạc Nitrat lấy dư - Kết tủa bạc clorua thu được có khối lượng là 0,717g. Tính thành phần phần trăm của mỗi chất trong hỗn hợp.
Bài giải
Gọi MNaCl là x và mKcl là y ta có phương trình đại số:
x + y = 0,35 (1)
PTHH: NaCl + AgNO3 -> AgCl ¯ + NaNO3
KCl + AgNO3 -> AgCl ¯ + KNO3
Dựa vào 2 PTHH ta tìm được khối lượng của AgCl trong mỗi phản ứng:
=> mAgCl = 2,444x + 1,919y = 0,717 (2)
Từ (1) và (2) => hệ phương trình 
Giải hệ phương trình ta được: x = 0,178
y = 0,147
% KCl = 100% - % NaCl = 100% - 54,76% = 45,24%.
Vậy trong hỗn hợp: NaCl chiếm 54,76%, KCl chiếm 45,24%
3. Phương pháp áp dụng định luật bảo toàn nguyên tố và khối lượng.
a/ Nguyên tắc:
Trong phản ứng hoá học, các nguyên tố và khối lượng của chúng được bảo toàn.
Từ đó suy ra:
+ Tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng các chất tạo thành.
+ Tổng khối lượng các chất trước phản ứng bằng tổng khối lượng các chất sau phản ứng.
b/ Phạm vi áp dụng:
Trong các bài toán xảy ra nhiều phản ứng, lúc này đôi khi không cần thiết phải viết các phương trình phản ứng và chỉ cần lập sơ đồ phản ứng để thấy mối quan hệ tỉ lệ mol giữa các chất cần xác định và những chất mà đề cho.
Bài 1. Cho một luồng khí clo dư tác dụng với 9,2g kim loại sinh ra 23,4g muối kim loại hoá trị I. Hãy xác định kim loại hoá trị I và muối kim loại đó.
Hướng dẫn giải:
Đặt M là KHHH của kim loại hoá trị I.
2M(g) (2M + 71)g
9,2g 23,4g
ta có: 23,4 x 2M = 9,2(2M + 71)
suy ra: M = 23.
Kim loại có khối lượng nguyên tử bằng 23 là Na.
Vậy muối thu được là: NaCl
Bài 2: Hoà tan hoàn toàn 3,22g hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lit hiđro (ở đktc) và dung dịch chứa m gam muối. Tính m?
Hướng dẫn giải:
PTHH chung: M + H2SO4  MSO4 + H2
MSO4 + H2
áp dụng định luật BTKL ta có:
mMuối = mX + m H SO
SO - m H
- m H = 3,22 + 98 * 0,06 - 2 * 0,06 = 8,98g
= 3,22 + 98 * 0,06 - 2 * 0,06 = 8,98g
Bài 3: Có 2 lá sắt khối lượng bằng nhau và bằng 11,2g. Một lá cho tác dụng hết với khí clo, một lá ngâm trong dung dịch HCl dư. Tính khối lượng sắt clorua thu được.
Hướng dẫn giải:
PTHH:
Theo phương trình (1,2) ta có:
nFeCl = nFe =
= nFe =  = 0,2mol nFeCl
= 0,2mol nFeCl = nFe =
= nFe =  = 0,2mol
= 0,2mol
Số mol muối thu được ở hai phản ứng trên bằng nhau nhưng khối lượng mol phân tử của FeCl3 lớn hơn nên khối lượng lớn hơn.
mFeCl = 127 * 0,2 = 25,4g mFeCl
= 127 * 0,2 = 25,4g mFeCl = 162,5 * 0,2 = 32,5g
= 162,5 * 0,2 = 32,5g
Bài 4: Hoà tan hỗn hợp 2 muối Cacbonnat kim loại hoá trị 2 và 3 bằng dung dịch HCl dư thu được dung dịch A và 0,672 lít khí (đktc).
Hỏi cô cạn dung dịch A thu được bao nhiêu gam muối khác nhau?
Bài giải:
Bài 1: Gọi 2 kim loại hoá trị II và III lần lượt là X và Y ta có phương trình phản ứng:
XCO3 + 2HCl -> XCl2 + CO2 + H2O (1)
Y2(CO3)3 + 6HCl -> 2YCl3 + 3CO2 + 3H2O (2).
Số mol CO2 thoát ra (đktc) ở phương trình 1 và 2 là:
Theo phương trình phản ứng 1 và 2 ta thấy số mol CO2 bằng số mol H2O.
Như vậy khối lượng HCl đã phản ứng là:
mHCl = 0,06 . 36,5 = 2,19 gam
Gọi x là khối lượng muối khan ( )
)
Theo định luật bảo toàn khối lượng ta có:
10 + 2,19 = x + 44 . 0,03 + 18. 0,03
=> x = 10,33 gam
Bài toán 2: Cho 7,8 gam hỗn hợp kim loại Al và Mg tác dụng với HCl thu được 8,96 lít H2 (ở đktc). Hỏi khi cô cạn dung dịch thu được bao nhiêu gam muối khan.
Bài giải: Ta có phương trình phản ứng như sau:
Mg + 2HCl -> MgCl2 + H2
2Al + 6HCl -> 2AlCl3 + 3H2
Số mol H2 thu được là:
Theo (1, 2) ta thấy số mol HCL gấp 2 lần số mol H2
Nên: Số mol tham gia phản ứng là:
n HCl = 2 . 0,4 = 0,8 mol
Số mol (số mol nguyên tử) tạo ra muối cũng chính bằng số mol HCl bằng 0,8 mol. Vậy khối lượng Clo tham gia phản ứng:
mCl = 35,5 . 0,8 = 28,4 gam
Vậy khối lượng muối khan thu được là:
7,8 + 28,4 = 36,2 gam
Dạng 4:Bài tập tính hiệu suất của phản ứng (H%)
a) Cơ sở lí thuyết :
Thực tế trong một phản ứng hoá học phụ thuộc vào rất nhiều yếu tố như nhiệt độ, chất xúc tác...làm cho chất tham gia phản ứng không tác dụng hết nghĩa là hiệu suất dưới 100%.Để tính được hiệu suất của phản ứng áp dụng một trong các cách sau:
1. Hiệu suất phản ứng tính theo 1 trong các chất sản phẩm của phản ứng:
2. Hiệu suất phản ứng tính theo chất thiếu tham gia phản ứng:
Chú ý: * Khối lượng thực tế là khối lượng đề bài cho
· Khối lượng lý thuyết là khối lượng tính theo phương trình
· Khi gặp bài toán cho biết lượng của cả 2 chất tham giathì phải lập tỉ số so sánh để xác định chất thiếu(chất phản ứng hết)
· Nếu gặp bài toán yêu cầu tính H% theo chuỗi phản ứng thì:
H% = tích H% của các giai đoạn phản ứng.
Giả sử có sơ đồ chuỗi phản ứng:A  B
B  C
C  D
D
 H% của chuỗi phản ứng = H1% . H2% . H3%
H% của chuỗi phản ứng = H1% . H2% . H3%
b.Bài tập vận dụng
Bài 1: Nung 150 kg CaCO3 thu được 67,2 kg CaO. Tính hiệu suất phản ứng.
Bài giải
Cách 1: tính theo chất sản phẩm.
 Phương trình hoá học : CaCO3 to
Phương trình hoá học : CaCO3 to CaO + CO2
CaO + CO2
100 kg 56 kg
150 kg x ? kg
Khối lượng CaO thu được ( theo lý thuyết) : x =  84 kg
84 kg
Hiệu suất phản ứng :
Cách 2: tính theo chất tham gia.
 Phương trình hoá học : CaCO3 to
Phương trình hoá học : CaCO3 to CaO + CO2
CaO + CO2
100 kg 56 kg
x ? kg 67,2 kg
Khối lượng CaCO3 cần lấy ( theo lý thuyết) : x =  = 120 kg
= 120 kg
Hiệu suất phản ứng :
 Bài 2 : Sắt được sản xuất theo sơ đồ phản ứng: Al + Fe2O3 Fe + Al2O3
Bài 2 : Sắt được sản xuất theo sơ đồ phản ứng: Al + Fe2O3 Fe + Al2O3
Tính khối lượng nhôm phải dùng để sản xuất được 168 gam Fe. Biết rằng hiệu suất phản ứng là 90%.
Bài giải
 Phương trình hoá học: 2Al + Fe2O3 to 2 Fe + Al2O3
Phương trình hoá học: 2Al + Fe2O3 to 2 Fe + Al2O3
2 mol 2 mol
x? mol 3 mol
Vậy x = 3 mol
Khối lượng Al tham gia phản ứng ( theo lý thuyết ): mAl = 3.27 = 81 gam
Vì H = 90% nên khối lượng nhôm thực tế phải dùng là :
Bài 3: Đốt cháy 11,2lit khí H2 (đktc) trong 4,48 lit khí O2 (đktc). Sau phản ứng thu được 3,6 gam nước ở trạng thái lỏng. Hãy tính H% phản ứng?
Bài giải:
n = 11,2 : 22,4 = 0,5 mol ; n
= 11,2 : 22,4 = 0,5 mol ; n = 4,48 : 22,4 = 0,2 mol ;
= 4,48 : 22,4 = 0,2 mol ;
- Phương trình hoá học : 2H2 + O2  2H2O
2H2O
2mol 1mol 2mol
- So sánh số mol giữa H2 và O2 :  >
>

 O2 thiếu.
O2 thiếu.
Vậy H% của phản ứng tính theo O2 .
- Theo phương trình phản ứng: nO2 =  = 0,1 mol
= 0,1 mol
Dạng 5: Toán liên quan đến tạp chất (Chất chưa tinh khiết )
a) Cơ sở lý thuyết:
* Tạp chất là chất có lẫn trong nguyên liệu ban đầu, nó không tham gia phản ứng.Vì vậy phải tính ra lượng nguyên chất trước khi thực hiện tính toán theo phương trình phản ứng.
ví dụ: Đem nung 350 kg đá vôi(CaCO3) có lẫn 10% tạp chất không tham gia phản ứng.
Hãy tính khối lượng vôi sống (CaO) thu được sau phản ứng?
Bài giải:
- Khối lượng tạp chất có trong mẫu đá vôi =  = 35 kg
= 35 kg
 Khối lượng CaCO3 nguyên chất = 350 – 35 = 315 kg
Khối lượng CaCO3 nguyên chất = 350 – 35 = 315 kg
100 (g) 56 (g)
315 (kg) ? (kg)
- Theo PTPư : khối lượng CaO =  = 176,4 kg
= 176,4 kg
* Nếu bài toán yêu cầu tính lượng chất cần lấy kể cả lượng tạp chất thì:
Tổng khối lượng cần lấy =  .100%
.100%
Ví dụ: Hãy tính khối lương đá vôi cần lấy để khi phân huỷ thu được 224 kg vôi sống biết trong mẫu đá vôi có 10% tạp chất.
Bài giải:
100 (g) 56 (g)
x ? kg 224 kg
Theo PTPư : khối lượng CaCO3 cần lấy =  = 400 kg
= 400 kg
Vậy tổng lượng đá vôi cần lấy ( kể cả tạp chất ) là :  = 444,44 kg.
= 444,44 kg.
* Nếu bài toán yêu cầu tính độ tinh khiết của chất thì:
Độ tinh khiết của chất =  . 100%
. 100%
Ví dụ : Đốt cháy 6,5 g lưu huỳnh không tinh khiết trong khí oxi dư được 4,48l khí SO2 ở đktc . Hãy Tính độ tinh khiết của mẫu lưu huỳnh trên?
Bàigiải:
Theo PTPư : mS = 0,2 x 32 = 6,4 gam
Độ tinh khiết của mẫu lưu huỳnh là :  x100% = 98,46%.
x100% = 98,46%.
Dạng 6: Dạng toán liên quan đến lượng lấy dư, sự hao hụt trong phản ứng.
a) Cơ sở lý thuyết:
- Lượng lấy dư một chất nhằm thực hiện phản ứng hoàn toàn 1 chất khác,lượng dư này không đưa vào phản ứng nên khi tính lượng cần dùng phải tính tổng lượng đủ cho phản ứng + lượng lấy dư.
- Lượng lấy dư thường được so sánh với lượng vừa đủ phản ứng , vì lượng vừa đủ phản ứng được coi là 100% nên nếu cả lượng lấy dư thì lượng chất cần phải lấy tổng cộng lớn hơn 100% so với lượng vừa đủ của phản ứng.
Tổng lượng chất cần phải lấy (g) = 

- Sự hao hụt trong quá trình phản ứng được coi như H% < 100%
Lúc đó H% phản ứng = 100% - % hao hụt
b) Bài tập vận dụng:
Bài 1: Hoà tan 5,6 g Fe trong một lượng axit HCl ( lấy dư 5% so với lượng vừa đủ phản ứng). Tính lượng axit HCl cần dùng?
Bài giải:
nFe = 5,6 : 56 = 0,1 mol
1mol 2mol
0,1mol ? mol
Theo PTPƯ : nHCl = 2 x 0,1 = 0,2mol  mHCl = 0,2 x 36,5 = 7,3 gam
mHCl = 0,2 x 36,5 = 7,3 gam
Vậy tổng lượng axit HCl phải lấy kể cả lượng dư 5% là:
Bài 2: Hãy tính V dung dịch HCl 2M cần dùng để hoà tan hết 10,8 gam Al, biết lượng HCl đã dùng dư 5% so với lượng phản ứng ?
Bài giải:
Phương trình phản ứng: 2Al + 6HCl = 2AlCl3 + 3H2
2mol 6mol 2mol 3mol
0,4mol x? mol
Theo PTPư : VddHCl 2M =  =
=  = 0,6lit
= 0,6lit
Do lượng HCl dùng dư 5% nên tổng V dd HCl cần lấy =  = 0,63lit
= 0,63lit
Bài 3: Trong phòng thí nghiệm cần điều chế 5,6 lit O2 (đktc) .Hỏi phải dùng bao nhiêu gam KClO3 biết rằng khí O2 thu được sau phản ứng bị hao hụt 10% .
Bài giải:
Phương trình phản ứng : 2KClO3  2KCl + 3O2
2KCl + 3O2
2mol 3mol
Theo PTPư: khối lượng KClO3 0,5/3 x 122,5 = 61,25/3 gam
Do có sự hao hụt 10% ( tức H% chỉ đạt 100% - 10% = 90% ) nên tổng khối lượng
4. Phương pháp dựa vào sự tăng, giảm khối lượng.
a/ Nguyên tắc:
So sánh khối lượng của chất cần xác định với chất mà giả thiết cho biết lượng của nó, để từ khối lượng tăng hay giảm này, kết hợp với quan hệ tỉ lệ mol giữa 2 chất này mà giải quyết yêu cầu đặt ra.
b/ Phạm vị sử dụng:
Đối với các bài toán phản ứng xảy ra thuộc phản ứng phân huỷ, phản ứng giữa kim loại mạnh, không tan trong nước đẩy kim loại yếu ra khỏi dung sịch muối phản ứng, ...Đặc biệt khi chưa biết rõ phản ứng xảy ra là hoàn toàn hay không thì việc sử dụng phương pháp này càng đơn giản hoá các bài toán hơn.
Bài 1: Nhúng một thanh sắt và một thanh kẽm vào cùng một cốc chứa 500 ml dung dịch CuSO4. Sau một thời gian lấy hai thanh kim loại ra khỏi cốc thì mỗi thanh có thêm Cu bám vào, khối lượng dung dịch trong cốc bị giảm mất 0,22g. Trong dung dịch sau phản ứng, nồng độ mol của ZnSO4 gấp 2,5 lần nồng độ mol của FeSO4. Thêm dung dịch NaOH dư vào cốc, lọc lấy kết tủa rồi nung ngoài không khí đến khối lượng không đổi , thu được 14,5g chất rắn. Số gam Cu bám trên mỗi thanh kim loại và nồng độ mol của dung dịch CuSO4 ban đầu là bao nhiêu?
Hướng dẫn giải:
PTHH
Gọi a là số mol của FeSO4
Vì thể tích dung dịch xem như không thay đổi. Do đó tỉ lệ về nồng độ mol của các chất trong dung dịch cũng chính là tỉ lệ về số mol.
Theo bài ra: CM ZnSO = 2,5 CM FeSO
= 2,5 CM FeSO Nên ta có: nZnSO
Nên ta có: nZnSO = 2,5 nFeSO
= 2,5 nFeSO
Khối lượng thanh sắt tăng: (64 - 56)a = 8a (g)
Khối lượng thanh kẽm giảm: (65 - 64)2,5a = 2,5a (g)
Khối lượng của hai thanh kim loại tăng: 8a - 2,5a = 5,5a (g)
Mà thực tế bài cho là: 0,22g
Ta có: 5,5a = 0,22  a = 0,04 (mol)
a = 0,04 (mol)
Vậy khối lượng Cu bám trên thanh sắt là: 64 * 0,04 = 2,56 (g)
và khối lượng Cu bám trên thanh kẽm là: 64 * 2,5 * 0,04 = 6,4 (g)
Dung dịch sau phản ứng 1 và 2 có: FeSO4, ZnSO4 và CuSO4 (nếu có)
Ta có sơ đồ phản ứng:
b b b (mol)
mCuO = 80b = 14,5 - 3,2 = 11,3 (g)  b = 0,14125 (mol)
b = 0,14125 (mol)
Vậy  nCuSO
nCuSO![]() ban đầu = a + 2,5a + b = 0,28125 (mol)
ban đầu = a + 2,5a + b = 0,28125 (mol)
Bài 2: Nhúng một thanh sắt nặng 8 gam vào 500 ml dung dịch CuSO4 2M. Sau một thời gian lấy lá sắt ra cân lại thấy nặng 8,8 gam. Xem thể tích dung dịch không thay đổi thì nồng độ mol/lit của CuSO4 trong dung dịch sau phản ứng là bao nhiêu?
Hướng dẫn giải:
Số mol CuSO4 ban đầu là: 0,5 x 2 = 1 (mol)
PTHH
1 mol 1 mol
56g 64g làm thanh sắt tăng thêm 64 - 56 = 8 gam
Mà theo bài cho, ta thấy khối lượng thanh sắt tăng là: 8,8 - 8 = 0,8 gam
Vậy có ![]() = 0,1 mol Fe tham gia phản ứng, thì cũng có 0,1 mol CuSO4 tham gia phản ứng.
= 0,1 mol Fe tham gia phản ứng, thì cũng có 0,1 mol CuSO4 tham gia phản ứng.
![]() Số mol CuSO4 còn dư : 1 - 0,1 = 0,9 mol
Số mol CuSO4 còn dư : 1 - 0,1 = 0,9 mol
Ta có CM CuSO![]() =
= ![]() = 1,8 M
= 1,8 M
Bài 3: Dẫn V lit CO2 (đktc) vào dung dịch chứa 3,7 gam Ca(OH)2. Sau phản ứng thu được 4 gam kết tủa. Tính V?
Hướng dẫn giải:
Theo bài ra ta có:
Số mol của Ca(OH)2 = ![]() = 0,05 mol
= 0,05 mol
Số mol của CaCO3 = ![]() = 0,04 mol
= 0,04 mol
PTHH
- Nếu CO2 không dư:
Ta có số mol CO2 = số mol CaCO3 = 0,04 mol
Vậy V(đktc) = 0,04 * 22,4 = 0,896 lít
- Nếu CO2 dư:
0,01![]() (0,05 - 0,04) mol
(0,05 - 0,04) mol
Vậy tổng số mol CO2 đã tham gia phản ứng là: 0,05 + 0,01 = 0,06 mol
 V(đktc) = 22,4 * 0,06 = 1,344 lít
V(đktc) = 22,4 * 0,06 = 1,344 lít
Bài 4: Hoà tan 20gam hỗn hợp hai muối cacbonat kim loại hoá trị 1 và 2 bằng dung dịch HCl dư thu được dung dịch X và 4,48 lít khí (ở đktc) tính khối lượng muối khan thu được ở dung dịch X.
Bài giải: Gọi kim loại hoá trị 1 và 2 lần lượt là A và B ta có phương trình phản ứng sau:
A2CO3 + 2HCl -> 2ACl + CO2 + H2O (1)
BCO3 + 2HCl -> BCl2 + CO2 + H2O (2)
Số mol khí CO2 (ở đktc) thu được ở 1 và 2 là:
![]()
Theo (1) và (2) ta nhận thấy cứ 1 mol CO2 bay ra tức là có 1 mol muối cacbonnat chuyển thành muối Clorua và khối lượng tăng thêm 11 gam (gốc CO3 là 60g chuyển thành gốc Cl2 có khối lượng 71 gam).
Vậy có 0,2 mol khí bay ra thì khối lượng muối tăng là:
0,2 . 11 = 2,2 gam
Vậy tổng khối lượng muối Clorua khan thu được là:
M(Muối khan) = 20 + 2,2 = 22,2 (gam)
Bài 5: Hoà tan 10gam hỗn hợp 2 muối Cacbonnat kim loại hoá trị 2 và 3 bằng dung dịch HCl dư thu được dung dịch A và 0,672 lít khí (đktc).
Hỏi cô cạn dung dịch A thu được bao nhiêu gam muối khác nhau?
Bài giải
Một bài toán hoá học thường là phải có phản ứng hoá học xảy ra mà có phản ứng hoá học thì phải viết phương trình hoá học là điều không thể thiếu.
Vậy ta gọi hai kim loại có hoá trị 2 và 3 lần lượt là X và Y, ta có phản ứng:
XCO3 + 2HCl -> XCl2 + CO2 + H2O (1)
Y2(CO3)3 + 6HCl -> 2YCl3 + 3CO2 + 3H2O (2).
Số mol chất khí tạo ra ở chương trình (1) và (2) là:
![]() = 0,03 mol
= 0,03 mol
Theo phản ứng (1, 2) ta thấy cứ 1 mol CO2 bay ra tức là có 1 mol muối Cacbonnat chuyển thành muối clorua và khối lượng tăng 71 - 60 = 11 (gam) (![]()
![]() ).
).
Số mol khí CO2 bay ra là 0,03 mol do đó khối lượng muối khan tăng lên:
11 . 0,03 = 0,33 (gam).
Vậy khối lượng muối khan thu được sau khi cô cạn dung dịch.
m (muối khan) = 10 + 0,33 = 10,33 (gam).
Bài 6: Hoà tan 20gam hỗn hợp hai muối cacbonat kim loại hoá trị 1 và 2 bằng dung dịch HCl dư thu được dung dịch X và 4,48 lít khí (ở đktc) tính khối lượng muối khan thu được ở dung dịch X.
Bài giải: Gọi kim loại hoá trị 1 và 2 lần lượt là A và B ta có phương trình phản ứng sau:
A2CO3 + 2HCl -> 2ACl + CO2 + H2O (1)
BCO3 + 2HCl -> BCl2 + CO2 + H2O (2)
Số mol khí CO2 (ở đktc) thu được ở 1 và 2 là:
![]()
Theo (1) và (2) ta nhận thấy cứ 1 mol CO2 bay ra tức là có 1 mol muối cacbonnat chuyển thành muối Clorua và khối lượng tăng thêm 11 gam (gốc CO3 là 60g chuyển thành gốc Cl2 có khối lượng 71 gam).
Vậy có 0,2 mol khí bay ra thì khối lượng muối tăng là:
0,2 . 11 = 2,2 gam
Vậy tổng khối lượng muối Clorua khan thu được là:
M(Muối khan) = 20 + 2,2 = 22,2 (gam)
Bài 1: Nhúng một thanh kim loại M hoá trị II vào 0,5 lit dd CuSO4 0,2M. Sau một thời gian phản ứng, khối lượng thanh M tăng lên 0,40g trong khi nồng độ CuSO4 còn lại là 0,1M.
a/ Xác định kim loại M.
b/ Lấy m(g) kim loại M cho vào 1 lit dd chứa AgNO3 và Cu(NO3)2 , nồng độ mỗi muối là 0,1M. Sau phản ứng ta thu được chất rắn A khối lượng 15,28g và dd B. Tính m(g)?
Hướng dẫn giải:
a/ theo bài ra ta có PTHH .
M + CuSO4 ![]() MSO4 + Cu (1)
MSO4 + Cu (1)
Số mol CuSO4 tham gia phản ứng (1) là: 0,5 ( 0,2 – 0,1 ) = 0,05 mol
Độ tăng khối lượng của M là:
mtăng = mkl gp - mkl tan = 0,05 (64 – M) = 0,40
giải ra: M = 56 , vậy M là Fe
b/ ta chỉ biết số mol của AgNO3 và số mol của Cu(NO3)2. Nhưng không biết số mol của Fe
![]()
![]()
![]() (chất khử Fe Cu2+ Ag+ (chất oxh mạnh)
(chất khử Fe Cu2+ Ag+ (chất oxh mạnh)
![]()
0,1 0,1 ( mol )
Ag+ Có Tính oxi hoá mạnh hơn Cu2+ nên muối AgNO3 tham gia phản ứng với Fe trước.
PTHH:
Fe + 2AgNO3 ![]() Fe(NO3)2 + 2Ag (1)
Fe(NO3)2 + 2Ag (1)
Fe + Cu(NO3)2 ![]() Fe(NO3)2 + Cu (2)
Fe(NO3)2 + Cu (2)
Ta có 2 mốc để so sánh:
- Nếu vừa xong phản ứng (1): Ag kết tủa hết, Fe tan hết, Cu(NO3)2 chưa phản ứng.
Chất rắn A là Ag thì ta có: mA = 0,1 x 108 = 10,8 g
- Nếu vừa xong cả phản ứng (1) và (2) thì khi đó chất rắn A gồm: 0,1 mol Ag và 0,1 mol Cu
mA = 0,1 ( 108 + 64 ) = 17,2 g
theo đề cho mA = 15,28 g ta có: 10,8 < 15,28 < 17,2
vậy AgNO3 phản ứng hết, Cu(NO3)2 phản ứng một phần và Fe tan hết.
mCu tạo ra = mA – mAg = 15,28 – 10,80 = 4,48 g. Vậy số mol của Cu = 0,07 mol.
Tổng số mol Fe tham gia cả 2 phản ứng là: 0,05 ( ở pư 1 ) + 0,07 ( ở pư 2 ) = 0,12 mol
Khối lượng Fe ban đầu là: 6,72g
5. Phương pháp ghép ẩn số.
Bài toán 1: (Xét lại bài toán đã nêu ở phương pháp thứ nhất)
Hoà tan hỗn hợp 20 gam hai muối cacbonnat kim loại hoá trị I và II bằng dung dịch HCl dư thu được dung dịch M và 4,48 lít CO2 (ở đktc) tính khối lượng muốn tạo thành trong dung dịch M.
Bài giải
Gọi A và B lần lượt là kim loại hoá trị I và II. Ta có phương trình phản ứng sau:
A2CO3 + 2HCl -> 2ACl + H2O + CO2 (1)
BCO3 + 2HCl -> BCl2 + H2O + CO2 (2)
Số mol khí thu được ở phản ứng (1) và (2) là:
![]()
Gọi a và b lần lượt là số mol của A2CO3 và BCO3 ta được phương trình đại số sau:
(2A + 60)a + (B + 60)b = 20 (3)
Theo phương trình phản ứng (1) số mol ACl thu được 2a (mol)
Theo phương trình phản ứng (2) số mol BCl2 thu được là b (mol)
Nếu gọi số muối khan thu được là x ta có phương trình:
(A + 35.5) 2a + (B + 71)b = x (4)
Cũng theo phản ứng (1, 2) ta có:
a + b = ![]() (5)
(5)
Từ phương trình (3, 4) (Lấy phương trình (4) trừ (5)) ta được:
11 (a + b) = x - 20 (6)
Thay a + b từ (5) vào (6) ta được:
11 . 0,2 = x - 20
=> x = 22,2 gam
Bài toán 2: Hoà tan hoàn toàn 5 gam hỗn hợp 2 kim loại bằng dung dịch HCl thu được dung dịch A và khí B, cô cạn dung dịch A thu được 5,71 gam muối khan tính thể tích khí B ở đktc.
Bài giải: Gọi X, Y là các kim loại; m, n là hoá trị, x, y là số mol tương ứng, số nguyên tử khối là P, Q ta có:
2X + 2n HCl => 2XCln = nH2 (I)
2Y + 2m HCl -> 2YClm + mH2 (II).
Ta có: xP + y Q = 5 (1)
x(P + 35,5n) + y(Q + 35,5m) = 5,71 (2)
Lấy phương trình (2) trừ phương trình (1) ta có:
x(P + 35,5n) + y(Q + 35,5m)- xP - yQ = 0,71
=> 35,5 (nx + my) = 0,71
Theo I và II: ![]()
=> thể tích: V = nx + my = ![]() (lít)
(lít)
6. Phương pháp chuyển bài toán hỗn hợp thành bài toán chất tương đương.
a/ Nguyên tắc:
Khi trong bài toán xảy ra nhiều phản ứng nhưng các phản ứng cùng loại và cùng hiệu suất thì ta thay hỗn hợp nhiều chất thành 1 chất tương đương. Lúc đó lượng (số mol, khối lượng hay thể tích) của chất tương đương bằng lượng của hỗn hợp.
b/ Phạm vi sử dụng:
Trong vô cơ, phương pháp này áp dụng khi hỗn hợp nhiều kim loại hoạt động hay nhiều oxit kim loại, hỗn hợp muối cacbonat, ... hoặc khi hỗn hợp kim loại phản ứng với nước.
Bài 1: Một hỗn hợp 2 kim loại kiềm A, B thuộc 2 chu kì kế tiếp nhau trong bảng hệ thống tuần hoàn có khối lượng là 8,5 gam. Hỗn hợp này tan hết trong nước dư cho ra 3,36 lit khí H2 (đktc). Tìm hai kim loại A, B và khối lượng của mỗi kim loại.
Hướng dẫn giải:
PTHH
2A + 2H2O ![]() 2AOH + H2 (1)
2AOH + H2 (1)
2B + 2H2O ![]() 2BOH + H2 (2)
2BOH + H2 (2)
Đặt a = nA , b = nB
ta có: a + b = 2 ![]() = 0,3 (mol) (I)
= 0,3 (mol) (I)
![]() trung bình:
trung bình: ![]() =
= ![]() = 28,33
= 28,33
Ta thấy 23 < ![]() = 28,33 < 39
= 28,33 < 39
Giả sử MA < MB thì A là Na, B là K hoặc ngược lại.
mA + mB = 23a + 39b = 8,5 (II)
Từ (I, II) ta tính được: a = 0,2 mol, b = 0,1 mol.
Vậy mNa = 0,2 * 23 = 4,6 g, mK = 0,1 * 39 = 3,9 g.
Bài 2: Hoà tan 115,3 g hỗn hợp gồm MgCO3 và RCO3 bằng 500ml dung dịch H2SO4 loãng ta thu được dung dịch A, chất rắn B và 4,48 lít CO2 (đktc). Cô cạn dung dịch A thì thu được 12g muối khan. Mặt khác đem nung chất rắn B tới khối lượng không đổi thì thu được 11,2 lít CO2 (đktc) và chất rắn B1. Tính nồng độ mol/lit của dung dịch H2SO4 loãng đã dùng, khối lượng của B, B1 và khối lượng nguyên tử của R. Biết trong hỗn hợp đầu số mol của RCO3 gấp 2,5 lần số mol của MgCO3.
Hướng dẫn giải:
Thay hỗn hợp MgCO3 và RCO3 bằng chất tương đương ![]() CO3
CO3
PTHH
![]() CO3 + H2SO4
CO3 + H2SO4 ![]()
![]() SO4 + CO2 + H2O (1)
SO4 + CO2 + H2O (1)
0,2 0,2 0,2 0,2
Số mol CO2 thu được là: nCO =
= ![]() = 0,2 (mol)
= 0,2 (mol)
Rắn B là ![]() CO3 dư:
CO3 dư:
![]() CO3
CO3 ![]()
![]() O + CO2 (2)
O + CO2 (2)
0,5 0,5 0,5
Theo phản ứng (1): từ 1 mol ![]() CO3 tạo ra 1 mol
CO3 tạo ra 1 mol ![]() SO4 khối lượng tăng 36 gam.
SO4 khối lượng tăng 36 gam.
Áp dụng định luật bảo toàn khối lượng ta có:
115,3 = mB + mmuối tan - 7,2
Vậy mB = 110,5 g
Theo phản ứng (2): từ B chuyển thành B1, khối lượng giảm là:
Vậy mB![]() = mB - mCO
= mB - mCO = 110,5 - 22 = 88,5 g
= 110,5 - 22 = 88,5 g
Tổng số mol ![]() CO3 là: 0,2 + 0,5 = 0,7 mol
CO3 là: 0,2 + 0,5 = 0,7 mol
Vì trong hỗn hợp đầu số mol của RCO3 gấp 2,5 lần số mol của MgCO3.
Nên 104,71 = ![]()
![]() R = 137
R = 137
Vậy R là Ba.
Bài 3: Để hoà tan hoàn toàn 28,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại thuộc phân nhóm chính nhóm II cần dùng 300ml dung dịch HCl aM và tạo ra 6,72 lit khí (đktc). Sau phản ứng, cô cạn dung dịch thu được m(g) muối khan. Tính giá trị a, m và xác định 2 kim loại trên.
Hướng dẫn giải:
Thay hỗn hợp bằng ![]() CO3
CO3
![]() CO3 + 2HCl
CO3 + 2HCl ![]()
![]() Cl2 + CO2 + H2O (1)
Cl2 + CO2 + H2O (1)
0,3 0,6 0,3 0,3
Theo tỉ lệ phản ứng ta có:
nHCl = 2 nCO = 2 * 0,3 = 0,6 mol
= 2 * 0,3 = 0,6 mol
CM HCl = ![]() = 2M
= 2M
Số mol của ![]() CO3 = nCO
CO3 = nCO = 0,3 (mol)
= 0,3 (mol)
Nên ![]() + 60 =
+ 60 = ![]() = 94,67
= 94,67
Gọi A, B là KHHH của 2 kim loại thuộc phân nhóm chính nhóm II, MA < MB
ta có: MA < ![]() = 34,67 < MB để thoả mãn ta thấy 24 <
= 34,67 < MB để thoả mãn ta thấy 24 < ![]() = 34,67 < 40.
= 34,67 < 40.
Vậy hai kim loại thuộc phân nhóm chính nhóm II đó là: Mg và Ca.
Khối lượng muối khan thu được sau khi cô cạn là: m = (34,67 + 71)* 0,3 = 31,7 gam.
7/ Phương pháp dựa theo số mol để giải toán hoá học.
a/ Nguyên tắc áp dụng:
Trong mọi quá trình biến đổi hoá học: Số mol mỗi nguyên tố trong các chất được bảo toàn.
b/ Ví dụ: Cho 10,4g hỗn hợp bột Fe và Mg (có tỉ lệ số mol 1:2) hoà tan vừa hết trong 600ml dung dịch HNO3 x(M), thu được 3,36 lit hỗn hợp 2 khí N2O và NO. Biết hỗn hợp khí có tỉ khối d = 1,195. Xác định trị số x?
Hướng dẫn giải:
Theo bài ra ta có:
nFe : nMg = 1 : 2 (I) và 56nFe + 24nMg = 10,4 (II)
Giải phương trình ta được: nFe = 0,1 và nMg = 0,2
Sơ đồ phản ứng.
Fe, Mg + HNO3 ------> Fe(NO3)3 , Mg(NO3)2 + N2O, NO + H2O
0,1 và 0,2 x 0,1 0,2 a và b (mol)
Ta có:
a + b = ![]() = 0,15 và
= 0,15 và ![]() = 1,195 ---> a = 0,05 mol và b = 0,1 mol
= 1,195 ---> a = 0,05 mol và b = 0,1 mol
Số mol HNO3 phản ứng bằng:
nHNO![]() = nN = 3nFe(NO
= nN = 3nFe(NO![]() )
)![]() + 2nMg(NO
+ 2nMg(NO![]() )
)![]() + 2nN
+ 2nN![]() O + nNO
O + nNO
= 3.0,1 + 2.0,2 + 2.0,05 + 0,1 = 0,9 mol
Nồng độ mol/lit của dung dịch HNO3:
x(M) = ![]() .1000 = 1,5M
.1000 = 1,5M
8/ Phương pháp biện luận theo ẩn số.
a/ Nguyên tắc áp dụng:
Khi giải các bài toán hoá học theo phương pháp đại số, nếu số phương trình toán học thiết lập được ít hơn số ẩn số chưa biết cần tìm thì phải biện luận ---> Bằng cách: Chọn 1 ẩn số làm chuẩn rồi tách các ẩn số còn lại. Nên đưa về phương trình toán học 2 ẩn, trong đó có 1 ẩn có giới hạn (tất nhiên nếu cả 2 ẩn có giới hạn thì càng tốt). Sau đó có thể thiết lập bảng biến thiên hay dự vào các điều kiện khác để chọn các giá trị hợp lí.
b/ Ví dụ:
Bài 1: Hoà tan 3,06g oxit MxOy bằng dung dich HNO3 dư sau đó cô cạn thì thu được 5,22g muối khan. Hãy xác định kim loại M biết nó chỉ có một hoá trị duy nhất.
Hướng dẫn giải:
PTHH: MxOy + 2yHNO3 -----> xM(NO3)2y/x + yH2O
Từ PTPƯ ta có tỉ lệ:
![]() =
= ![]() ---> M = 68,5.2y/x
---> M = 68,5.2y/x
Trong đó: Đặt 2y/x = n là hoá trị của kim loại. Vậy M = 68,5.n (*)
Cho n các giá trị 1, 2, 3, 4. Từ (*) ---> M = 137 và n =2 là phù hợp.
Do đó M là Ba, hoá trị II.
Bài 2: A, B là 2 chất khí ở điều kiện thường, A là hợp chất của nguyên tố X với oxi (trong đó oxi chiếm 50% khối lượng), còn B là hợp chất của nguyên tố Y với hiđrô (trong đó hiđro chiếm 25% khối lượng). Tỉ khối của A so với B bằng 4. Xác định công thức phân tử A, B. Biết trong 1 phân tử A chỉ có một nguyên tử X, 1 phân tử B chỉ có một nguyên tử Y.
Hướng dẫn giải:
Đặt CTPT A là XOn, MA = X + 16n = 16n + 16n = 32n.
Đặt CTPT A là YOm, MB = Y + m = 3m + m = 4m.
d = ![]() =
= ![]() = 4 ---> m = 2n.
= 4 ---> m = 2n.
Điều kiện thoả mãn: 0 < n, m < 4, đều nguyên và m phải là số chẵn.
Vậy m chỉ có thể là 2 hay 4.
Nếu m = 2 thì Y = 6 (loại, không có nguyên tố nào thoả)
Nếu m = 4 thì Y = 12 (là cacbon) ---> B là CH4
và n = 2 thì X = 32 (là lưu huỳnh) ---> A là SO2
9/ Phương pháp dựa vào các đại lượng có giới hạn để tìm giới hạn của một đại lượng khác.
a/ Nguyên tắc áp dụng:
Dựa vào các đại lượng có giới hạn, chẳng hạn:
KLPTTB (![]() ), hoá trị trung bình, số nguyên tử trung bình, ....
), hoá trị trung bình, số nguyên tử trung bình, ....
Hiệu suất: 0(%) < H < 100(%)
Số mol chất tham gia: 0 < n(mol) < Số mol chất ban đầu,...
Để suy ra quan hệ với đại lượng cần tìm. Bằng cách:
- Tìm sự thay đổi ở giá trị min và max của 1 đại lượng nào đó để dẫn đến giới hạn cần tìm.
- Giả sử thành phần hỗn hợp (X,Y) chỉ chứa X hay Y để suy ra giá trị min và max của đại lượng cần tìm.
b/ Ví dụ:
Bài 1: Cho 6,2g hỗn hợp 2 kim loại kiềm thuộc 2 chu kỳ liên tiếp trong bảng tuần hoàn phản ứng với H2O dư, thu được 2,24 lit khí (đktc) và dung dịch A.
a/ Tính thành phần % về khối lượng từng kim loại trong hỗn hợp ban đầu.
Hướng dẫn:
a/ Đặt R là KHHH chung cho 2 kim loại kiềm đã cho
MR là khối lượng trung bình của 2 kim loại kiềm A và B, giả sử MA < MB
---.> MA < MR < MB .
Viết PTHH xảy ra:
Theo phương trình phản ứng:
nR = 2nH = 0,2 mol. ----> MR = 6,2 : 0,2 = 31
= 0,2 mol. ----> MR = 6,2 : 0,2 = 31
Theo đề ra: 2 kim loại này thuộc 2 chu kì liên tiếp, nên 2 kim loại đó là:
A là Na(23) và B là K(39)
Bài 2:
a/ Cho 13,8 gam (A) là muối cacbonat của kim loại kiềm vào 110ml dung dịch HCl 2M. Sau phản ứng thấy còn axit trong dung dịch thu được và thể tích khí thoát ra V1 vượt quá 2016ml. Viết phương trình phản ứng, tìm (A) và tính V1 (đktc).
b/ Hoà tan 13,8g (A) ở trên vào nước. Vừa khuấy vừa thêm từng giọt dung dịch HCl 1M cho tới đủ 180ml dung dịch axit, thu được V2 lit khí. Viết phương trình phản ứng xảy ra và tính V2 (đktc).
Hướng dẫn:
a/ M2CO3 + 2HCl ---> 2MCl + H2O + CO2
Theo PTHH ta có:
Số mol M2CO3 = số mol CO2 > 2,016 : 22,4 = 0,09 mol
---> Khối lượng mol M2CO3 < 13,8 : 0,09 = 153,33 (I)
Mặt khác: Số mol M2CO3 phản ứng = 1/2 số mol HCl < 1/2. 0,11.2 = 0,11 mol
---> Khối lượng mol M2CO3 = 13,8 : 0,11 = 125,45 (II)
Từ (I, II) --> 125,45 < M2CO3 < 153,33 ---> 32,5 < M < 46,5 và M là kim loại kiềm
---> M là Kali (K)
Vậy số mol CO2 = số mol K2CO3 = 13,8 : 138 = 0,1 mol ---> VCO![]() = 2,24 (lit)
= 2,24 (lit)
b/ Giải tương tự: ---> V2 = 1,792 (lit)
Bài 3: Cho 28,1g quặng đôlômít gồm MgCO3; BaCO3 (%MgCO3 = a%) vào dung dịch HCl dư thu được V (lít) CO2 (ở đktc).
a/ Xác định V (lít).
Hướng dẫn:
a/ Theo bài ra ta có PTHH:
MgCO3 + 2HCl ![]() MgCl2 + H2O + CO2 (1)
MgCl2 + H2O + CO2 (1)
x(mol) x(mol)
BaCO3 + 2HCl ![]() BaCl2 + H2O + CO2 (2)
BaCl2 + H2O + CO2 (2)
y(mol) y(mol)
0,2(mol)![]() 0,2(mol)
0,2(mol)![]() 0,2(mol)
0,2(mol)
CO2 + CaCO3 + H2O ![]() Ca(HCO3)2 (4)
Ca(HCO3)2 (4)
Giả sử hỗn hợp chỉ có MgCO3.Vậy mBaCO3 = 0
Số mol: nMgCO3 = ![]() = 0,3345 (mol)
= 0,3345 (mol)
Nếu hỗn hợp chỉ toàn là BaCO3 thì mMgCO3 = 0
Số mol: nBaCO3 =![]() = 0,143 (mol)
= 0,143 (mol)
Theo PT (1) và (2) ta có số mol CO2 giải phóng là:
0,143 (mol) ![]() nCO2
nCO2 ![]() 0,3345 (mol)
0,3345 (mol)
Vậy thể tích khí CO2 thu được ở đktc là: 3,2 (lít) ![]() VCO
VCO![]()
![]() 7,49 (lít)
7,49 (lít)
Tags: Hóa 9, Hóa Học Lớp 9, Ôn HSG Hóa Học 9









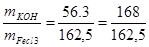











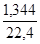



































 Trang Trước
Trang Trước






Hay wa
ReplyDeletehơi khó hiểu nhưng mà hay wÁ!!!!!!
ReplyDelete