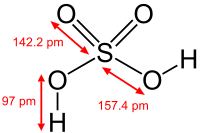
- CTPT: H2SO4
- CTCT:
Trong hợp chất H2SO4, nguyến tố S có số oxi hoá cực đại là +6.
2. TÍNH CHẤT VẬT LÍ
- là chất lỏng, không màu, sánh như dầu, không bay hơi.
- H2SO4 98% có D= 1,84 g/cm3; nặng gần gấp 2 lần nước.
- H2SO4 đặc rất hút ẩm -> dùng làm khô khí ẩm.
- H2SO4 đặc tan vô hạn trong nước và toả nhiều nhiệt.
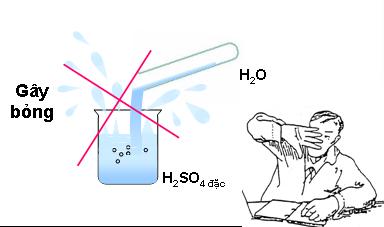
Giảithích hiện tượng thí nghiệm? Từ đó rút ra cách pha loãng axit sunfuric đặc?
- Khi pha loãng axit sunfuric đặc thì rót từ từ axit vào nước và khuấy nhẹ; không làm ngược lại ( nguy hiểm) (Tại sao?)
- Axit sunfuric đặc gây bỏng rất nặng -> cẩn thận khi làm thí nghiệm với axit sunfuric đặc
cô gái bị bỏng axit
3. TÍNH CHẤT HOÁ HỌC
a. Tính chất của axit sunfuric loãng
- Tính axit mạnh. Axit tác dụng được với chất nào?
+ Làm quì tím hoá đỏ
+ Tác dụng với muối (điều kiện: sản phẩm kết tủa hoặc bay hơi)
+ Tác dụng với oxit bazơ hoặc bazơ -> muối + H2O
+ Tác dụng kim loại trước hiđro ->muối hoá trị thấp của KL + H2
b. Tính chất của axit sunfuric đặc
Cu + H2SO4 loãng -> không phản ứng
Cu + H2SO4 đặc -> có xảy ra phản ứng không?
Nhận xét hiện tượng? Ngoài tính axit mạnh như axit sunfuric loãng thì axit sunfuric đặc còn có tính chất gì?
- Ngoài tính axit mạnh như axit sunfuric loãng thì axit sunfuric đặc còn có tính chất đặc trưng sau:
b.1. Tính oxi hoá mạnh
+ Tác dụng với kim loại ( hầu hết kim loại trừ Au, Pt)
+ Tác dụng với phi kim ( C, S, P)
+ Tác dụng với hợp chất có tính khử ( HI, KI, KBr, FeO, Fe3O4, Fe(OH)2, FeCO3, H2S, …)
Nhỏ axit sunfuric đặc vào giấy
Nhận xét hiện tượng? Suy ra axit sunfuric đặc còn có tính chất gì?
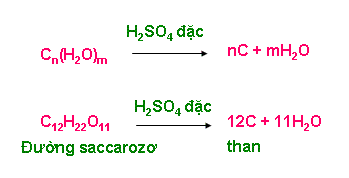
b.2. Tính háo nước
- Axit H2SO4 đặc chiếm nước kết tinh của nhiều muối hiđrat (muối ngậm nước) hoặc chiếm các nguyên tố H và O (thành phần của nước) trong nhiều hợp chất
+ Hợp chất cacbohiđrat (Cn(H2O)m)
+ CuSO4.5H2O
Phim thí nghiệm tính háo nước
Nhận xét hiện tượng? Vận dụng kiến thức trên, em hãy giải thích hiện tượng?
4. ỨNG DỤNG
- Hàng năm, thế giới sản xuất khoảng 160 triệu tấn H2SO4. Axit sunfuric là hoá chất hàng đầu trong nhiều ngành sản xuất như: phẩm nhuộm, luyện kim, chất dẻo, chất tẩy rửa, giấy sợi, sơn, phân bón, …
5. Sơ đồ sản xuất axit sunfuric
- Phương pháp tiếp xúc, gồm 3 công đoạn chính
a) Sản xuất SO2
- Từ quặng pirit sắt (FeS2)
- Từ lưu huỳnh
b) Sản xuất SO3
c) Sản xuất H2SO4
Dùng H2SO4 98% hấp thụ SO3 được oleum H2SO4.nSO3
Dùng lượng nước thích hợp để pha loãng oleum, được H2SO4 đặc
CỦNG CỐ
CÁC BẠN HÃY TRẢ LỜI CÁC CÂU HỎI SAU NHÉ!
1. Số oxi hoá của S trong các chất: SO2, SO3, S, H2S, H2SO4, Na2SO4 lần lượt là:
A. +4, +4, 0, -2, +6, +6.
B. +4, +6, 0, -2, +6, +4.
C. +4, +6, 0, -2, +6, +6.
D. +4, +6, 0, -2, +4, +6.
2. Khí oxi có lẫn hơi nước. Chất nào sau đây là tốt nhất để tách hơi nước ra khỏi khí oxi?
A. Nhôm oxit.
B. Axit sunfuric đặc.
C. Nước vôi trong.
D. Dung dịch natri hiđroxit.
3. Có thể dùng H2SO4 đặc để làm khan (làm khô) tất cả các khí trong dãy nào?
A. CO2, NH3, H2, N2.
B. CO2, H2, N2, O2.
C. CO2, N2, SO2, O2.
D. CO2, H2S, N2, O2.
4. Để pha loãng dung dịch H2SO4 đặc, trong phòng thí nghiệm, người ta tiến hành theo cách nào dưới đây?
A. cho từ từ nước vào axit và khuấy đều.
B. cho từ từ axit vào nước và khuấy đều.
C. cho nhanh nước vào axit và khuấy đều.
D. cho nhanh axit vào nước và khuấy đều.
5. Phản ứng nào sau đây là sai?
A. 2FeO + 4H2SO4 đặc -> Fe2(SO4)3 + SO2 + 4H2O.
B. Fe2O3 + 4H2SO4 đặc -> Fe2(SO4)3 + SO2 + 4H2O.
C. FeO + H2SO4 loãng -> FeSO4 + H2O.
D. Fe2O3 + 3H2SO4 loãng -> Fe2(SO4)3 + 3H2O.
6. H2SO4 đặc nguội không thể tác dụng với nhóm kim loại nào sau đây?
A. Fe, Zn.
B. Fe, Al.
C. Al, Zn.
D. Al, Mg.
7. Trong sản xuất H2SO4 trong công nghiệp người ta cho khí SO3hấp thụ vào
A. H2O.
B. dung dịch H2SO4 loãng.
C. H2SO4 đặc để tạo oleum.
D. H2O2.
8. Cho FeCO3 tác dụng với H2SO4 đặc nóng dư. Sản phẩm khí thu được là:
A. CO2 và SO2.
B. H2S và CO2.
C. SO2.
D. CO2.



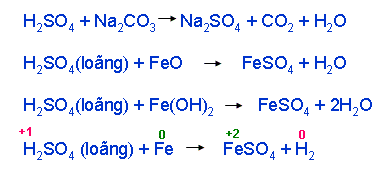
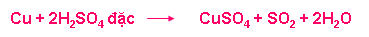

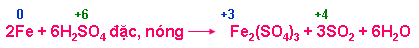
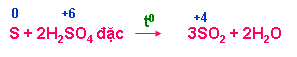
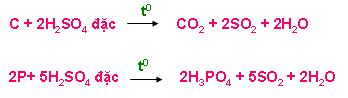
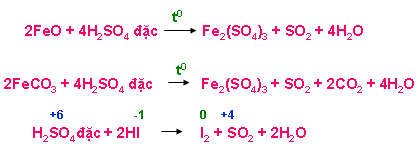

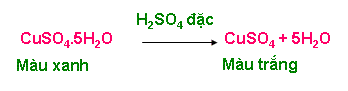
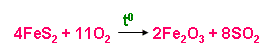
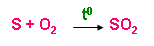
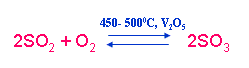
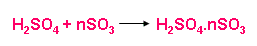
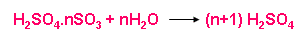
 Trang Trước
Trang Trước






No comments: