Tổng Hợp Hữu Cơ 2
II. Các phương pháp làm giảm mạch Cacbon:
1. Phản ứng đecacboxyl hóa bởi nhiệt: xảy ra khi nhóm COOH gắn với nhóm có khả năng hút electron mạnh
2. Phương pháp vôi tôi xút: RCOONa + NaOH  RH + Na2CO3
RH + Na2CO3
3. Phản ứng Hunzdicker: RCOOAg + Br2  RBr + CO2 + AgBr
RBr + CO2 + AgBr
4. Phản ứng halofom:RCOCH3 + 3X2 + 4NaOH  RCOONa + CHX3 + 3NaX + 3H2O
RCOONa + CHX3 + 3NaX + 3H2O
5. Phản ứng thoái phân Hoffman: R – CO – NH2  RNH2
RNH2
6. Các phản ứng oxi hóa làm gãy mạch Cacbon:
a) Các phản ứng làm gãy liên kết liên kết đôi C=C:
CH3–CH= C(CH3)2

+
 CH3–COOH + CH3–CO–CH3
CH3–COOH + CH3–CO–CH3
b) Các phản ứng làm gãy liên kết C – C vic-điol:
c) Phản ứng oxi hóa ankyl, ankenyl hoặc dẫn xuất của benzen:
* Học sinh cần lưu ý:
+ Nếu vị trí α của mạch bên không còn H thì phản ứng oxi hóa hầu như không xảy ra.
+ Nếu dùng Na2Cr2O7 (không có H+) sẽ tạo thành xeton mà không bị cắt mạch
+ Nếu vị trí α của mạch bên chỉ còn 1 nguyên tử H thì phản ứng sẽ tạo ra ancol bậc 3 (không cắt mạch cacbon)
III. Các phương pháp tạo vòng:
1. Các phương pháp ankyl, axyl hóa và ngưng tụ nội phân tử: nguyên tắc tương tự như các phản ứng ankyl, axyl hóa và ngưng tụ đã nêu ở trên.
2. Phản ứng cộng Diels – Alder:
đien đienophin
* Học sinh cần lưu ý:
+ Đien phải ở cấu dạng s-cis; dạng s-trans (Ví dụ:  ) không phản ứng.
) không phản ứng.
+ Các nhóm thế ở vị trí cis đầu mạch đien gây cản trở không gian ® khó phản ứng.
+ Đien có nhóm thế đẩy electron (không gây cản trở không gian) ® tăng khả năng phản ứng.
+ Đienophin có nhóm thế hút electron ® tăng khả năng phản ứng.
+ Cấu hình của sản phẩm giống với cấu hình của đienophin.
+ Hướng của phản ứng:
IV. Các phản ứng oxi hóa và khử trong tổng hợp hữu cơ:
1. Các phản ứng oxi hóa:
a) Các phản ứng oxi hóa anken
b) Phản ứng oxi hóa nguyên tử H ở vị trí allyl:
Tác nhân oxi hóa: Pb4+, SeO2…
c) Các phản ứng oxi hóa ankyl, ankenyl hoặc dẫn xuất của benzen
d) Các phản ứng oxi hóa ancol:
Tác nhân oxi hóa: CuO, K2Cr2O7/H+, CrO3/H+…
 + Ancol bậc I
+ Ancol bậc I  anđehit
anđehit
(Quá trình oxi hóa ancol bậc I thành anđehit cần khống chế cẩn thận để không chuyển thành axit).
e) Các phản ứng oxi hóa anđehit, xeton:
Tác nhân oxi hóa: O2/xt, [Ag(NH3)2]+, KMnO4/H+, K2Cr2O7/H+…
+ Xeton  bị cắt mạch thành axit cacboxylic và xeton
bị cắt mạch thành axit cacboxylic và xeton
Tác nhân oxi hóa: KMnO4/H+, HNO3…
2. Các phản ứng khử:
a) Phương pháp hidro hóa xúc tác:
Tác nhân khử:
+ H2/ Ni, Pt, Pd:
RCOCl ® RCH=O
RCH=O ® RCH2OH
R-CO-R' ® R-CH(OH)-R'
R-COO-R' ® RCH2OH + R'OH
RX ® RH
RNO2 ® RNH2
R-CºN ® R-CH2NH2
R-CO-NHR' ® RCH2NHR'
+ H2/ Pd/ BaSO4, BaCO3… (xúc tác Lindlar): khử lựa chọn liên kết ba về liên kết đôi
+ H2/ [(C6H5)3P]3RhCl: khử lựa chọn liên kết đôi C=C chỉ chứa 1 hoặc 2 nhóm thế.
* Học sinh cần lưu ý: đặc thù lập thể của các phản ứng này đều là cộng syn
b) Phương pháp khử bằng hidrua kim loại:
Tác nhân khử: thường dùng LiAlH4, NaBH4
RCOCl ® RCH2OH
RCH=O ® RCH2OH
R-CO-R' ® R-CH(OH)-R'
R-COO-R' ® RCH2OH + R'OH
Không khử được bằng NaBH4
Epoxit ® 1,2-điol
RX ® RH
RNO2 ® RNH2
R-CºN ® R-CH2NH2
R-CO-NHR' ® RCH2NHR'
* Học sinh cần lưu ý: phản ứng khử xảy ra theo cơ chế cộng AN.
c) Các phương pháp khử bằng kim loại hòa tan:
Tác nhân khử:
+ Na/NH3 lỏng:  (lập thể: cộng trans)
(lập thể: cộng trans)
+ Na/ C2H5OH: RCOOH ® RCH2OH
R-COO-R' ® RCH2OH + R'OH
+ Zn (Hg)/ HCl: R-CO-R' ® R-CH2-R'
V. Bảo vệ nhóm chức:
* Điều kiện của nhóm bảo vệ:
+ Được tạo ra trong điều kiện nhẹ nhàng
+ Ổn định trong suốt quá trình phản ứng ở các trung tâm phản ứng khác.
+ Dễ tái sinh nhóm chức ban đầu.
1. Bảo vệ nhóm ancol:
a) Chuyển thành nhóm ete:
b) Chuyển thành nhóm este (nhóm este tương đối bền trong môi trường axit):
c) Chuyển thành nhóm axetal hoặc xetal (bảo vệ các điol):
2. Bảo vệ nhóm cacbonyl:
Tạo thành axetal hoặc xetal tương tự như bảo vệ các điol; thường sử dụng etilen glycol.
3. Bảo vệ nhóm cacboxyl:
Chuyển thành nhóm este; thường tạo thành tert-butyl este (dễ loại bằng H+) hoặc benzyl este (dễ loại bằng hidro phân)
4. Bảo vệ nhóm amino:
























 Trang Trước
Trang Trước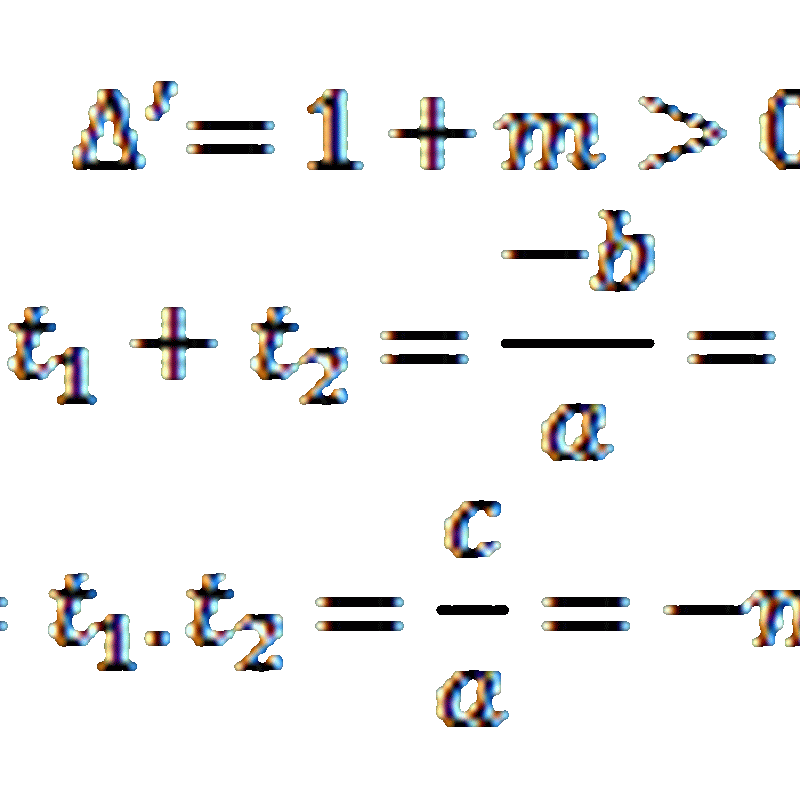







No comments: