Ôn thi Đại Học–hóa vô cơ
LÝ THUYẾT VÔ CƠ
A.1.
Từ các sơ đồ phản ứng sau :
a) X1 + X2 ![]() Ca(OH)2 + H2 b) X3 + X4
Ca(OH)2 + H2 b) X3 + X4 ![]() CaCO3 + Na2CO3 + H2O
CaCO3 + Na2CO3 + H2O
c) X3 + X5 ![]() Fe(OH)3 + NaCl + CO2 d) X6 + X7 + X2
Fe(OH)3 + NaCl + CO2 d) X6 + X7 + X2 ![]() Al(OH)3 + NH3 + NaCl
Al(OH)3 + NH3 + NaCl
Các chất thích hợp với X2, X3, X4, X5 tương ứng là
A. Ca ; NaOH ; Ca(HCO3)2 ; FeCl3 B. H2O ; Ca(HCO3)2 ; NaOH ; FeCl3
C. H2O ; NaHCO3 ; Ca(OH)2 ; FeCl3 D. Ca ; Ca(OH)2 ; NaHCO3 ; FeCl3
A.2.
Cho các chất Cu, FeO, Fe3O4, C, FeCO3, Fe(OH)2, Fe tác dụng lần lượt với H2SO4 đặc, nóng đều giải phóng khí SO2. Nhóm các chất mà khi tác dụng với 1 mol H2SO4 đều giải phóng ra 1/ 4 mol SO2 gồm
A. Cu, FeO, Fe3O4 B. FeO, Fe3O4, C
C. Fe3O4, FeCO3, Fe D. FeO, FeCO3, Fe(OH)2
A.3.
Điểm giống nhau khi sục khí CO2 lần lượt vào các dung dịch nước vôi trong (I), natri phenolat (II), natri aluminat (III) ; sục khí ozon vào dung dịch KI (IV) ; sục khí sunfurơ vào dung dịch H2S (V) là hiện tượng dung dịch bị vẩn đục, nhưng bản chất của các phản ứng khác nhau như sau :
A. (II), (III) khác với (I), (IV), (V) B. (I), (II), (III) khác với (IV), (V)
C. (I), (II), khác với (III), (IV), (V) D. (III), (IV) khác với (I), (II), (V)
A.4.
Trong một cốc nước có hoà tan a mol Ca(HCO3)2 và b mol Mg(HCO3)2. Để khử độ cứng của nước trong cốc cần dùng V lít nước vôi trong, nồng độ p mol/lit. Biểu thức liên hệ giữa V với a, b, p là
A. V = (a + b)/p B. V = 2(a + b)/p C. V = (a + b)/2p D. V = (a + b) p
A.5.
Khí X không màu, mùi xốc, được điều chế bằng phản ứng của đồng với axit sunfuric đặc, nóng. Cho X lội chậm qua nước brôm màu vàng ( bình1) và nước hiđro sunfua ( bình 2), hiện tượng quan sát được ở các bình 1 và bình 2 tương ứng là
A. (1) dung dịch không đổi màu ; (2) có khí thoát ra mùi trứng thối.
B. (1) dung dịch mất màu ; (2) có kết tủa màu vàng.
C. (1) dung dịch mất màu ; (2) không có hiện tượng gì.
D. (1) dung dịch không đổi màu ; (2) có kết tủa màu vàng.
A.6.
Nhóm các phân tử, nguyên tử và ion có tổng số electron bằng nhau :
A. Na, Al3+, CH4, H2S, NH3, Mg B. Na+, Al3+, CH4, H2O, NH3, Mg2+
C. Na, Al3+, CH4, H2S, NH3, HF D. Na, Al3+, SiH4, H2O, NH3, Mg2+
A.7.
Cho sơ đồ phản ứng : X + HNO3 loãng ![]() Fe(NO3)3 + NO
Fe(NO3)3 + NO ![]() + H2O. Số chất X có thể thực hiện phản ứng trên là
+ H2O. Số chất X có thể thực hiện phản ứng trên là
A. 3 B. 4 C. 5 D. 6
A.8.
Hỗn hợp X chứa K2O, NH4Cl, KHCO3 và BaCl2 có số mol bằng nhau. Cho hỗn hợp X vào nước (dư), đun nóng, dung dịch thu được chứa
A. KCl, KOH B. KCl C. KCl, KHCO3, BaCl2 D. KCl, KOH, BaCl2
A.9.
Cho Ba kim loại lần lượt vào các dung dịch sau: NaHCO3, CuSO4, (NH4)2CO3, NaNO3, MgCl2. Số dung dịch tạo kết tủa là
A. 1 B. 2 C. 3 D. 4
A.10.
Cho một ít bột sắt vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm
A. Fe(NO3)2 , H2O B. Fe(NO3)2 , AgNO3 dư, H2O
C. Fe(NO3)3 , AgNO3 dư, H2O D. Fe(NO3)2 , Fe(NO3)3 , AgNO3 dư, H2O
A.11.
Dãy nào sau đây xếp theo chiều tăng dần bán kính của các ion?
A. Al3+ ; Mg2+; Na+ ; F- ; O2- B. Na+; O2-; Al3+ ; F-; Mg2+
C. O2-; F-; Na+; Mg2+; Al3+ D. F-; Na+; O2-; Mg2+; Al3+
A.12.
Hoá chất T là một chất bột màu trắng, biết rằng T chỉ có thể là một trong các hoá chất sau : MgCl2, CaCO3, BaCl2, CaSO4. Để xác định T là hoá chất nào có thể dùng thuốc thử nào sau đây ?
A. H2O và HCl B. H2O và NaOH C. H2O và HNO3 D. H2O và H2SO4
A.13.
Có 3 gói bột trắng không ghi nhãn, mỗi gói chứa riêng rẽ hỗn hợp 2 chất sau : NaCl và KCl ; Na2CO3 và K2CO3 ; MgSO4 và BaCl2. Người ta chỉ dùng 1 hoá chất là có thể nhận ra được 3 gói bột trắng trên. Hoá chất nào trong các hoá chất sau không dùng để phân biệt được 3 gói bột trắng trên:
A. dung dịch HCl B. dung dịch Ba(OH)2 C. dung dịch H2SO4 D. H2O
A.14.
Hoà tan hoàn toàn FeS2 vào cốc chứa dung dịch HNO3 loãng được dung dịch X và khí NO thoát rA. Thêm bột Cu dư và axit sunfuric vào dung dịch X, được dung dịch Y có màu xanh, nhưng không có khí thoát rA. Các chất tan có trong dung dịch Y là:
A. Cu(NO3)2 ; Fe(NO3)3 ; H2SO4 B. Cu(NO3)2 ; Fe(NO3)2 ; H2SO4
C. CuSO4 ; Fe2(SO4)3 ; H2SO4 D. CuSO4 ; FeSO4 ; H2SO4
A.15.
Cho chất vô cơ X tác dụng với một lượng vừa đủ KOH, đun nóng, thu được khí X1 và dung dịch X2. Khí X1 tác dụng với một lượng vừa đủ CuO nung nóng, thu được khí X3, H2O, Cu. Cô cạn dung dịch X2 được chất rắn khan X4 (không chứa clo). Nung X4 thấy sinh ra khí X5 ( M=32đvC). Nhiệt phân X thu được khí X6 (M= 44đvC) và nướC. Các chất X1, X3, X4, X5, X6 lần lượt là:
A. NH3 ; NO ; KNO3 ; O2 ; CO2 B. NH3 ; N2 ; KNO3 ; O2 ; N2O
C. NH3 ; N2 ; KNO3 ; O2 ; CO2 D. NH3 ; NO ; K2CO3 ; CO2 ; O2.
A.16.
Điều khẳng định nào sau đây không đúng:
A. Phản ứng NH4NO3 + KOH ![]() KNO3 + NH3 + H2O dùng điều chế NH3 trong PTN
KNO3 + NH3 + H2O dùng điều chế NH3 trong PTN
B. Phản ứng 2NH3 + 3CuO ![]() 3Cu + N2 + 3H2O dùng minh hoạ tính khử của NH3
3Cu + N2 + 3H2O dùng minh hoạ tính khử của NH3
C. Phản ứng 2KNO3 ![]() 2KNO2 + O2 dùng điều chế O2 trong PTN
2KNO2 + O2 dùng điều chế O2 trong PTN
D. Phản ứng NH4NO3 ![]() 2H2O + N2O dùng điều chế N2O trong công nghiệp.
2H2O + N2O dùng điều chế N2O trong công nghiệp.
A.17.
Sau khi cân bằng phương trình phản ứng: FexOy + HNO3 ® Fe(NO3)3 + NO + H2O, theo tỷ lệ hệ số nguyên, đơn giản nhất, thì tổng hệ số của HNO3 và NO là:
A. 15x - 4y B. 12x- 3y C. 9x-3y D. 18x- 5y
A.18.
Trong công nghiệp HCl có thể điều chế bằng phương pháp sulfat theo phương trình phản ứng:
2NaCl (tinh thể) + H2SO4 (đặc) ![]() 2HCl ↑ + Na2SO4
2HCl ↑ + Na2SO4
Tại sao phương pháp này không được dùng để điều chế HBr và HI ?
A. Do tính axit của H2SO4 yếu hơn HBr và HI B. Do NaBr và NaI đắt tiền, khó kiếm
C. Do HBr và HI sinh ra là chất độc D. Do Br-, I- có phản ứng với H2SO4 đặc, nóng
A.19.
Để nhận biết được 4 kim loại: Ag, Na, Mg và Al. chỉ cần dùng hóa chất nào sau đây?
A. H2O B. dd NaOH loãng C. dd HCl loãng D. dd NH3
A.20.
Cho từ từ kim loại M vào dd (NH4)2SO4 đến dư, thấy có hỗn hợp khí bay ra và thu được dd trong suốt . Kim loại M là:
A. Ba B. Fe C. Na D. Mg
A.21.
Có thể dùng NaOH (ở thể rắn) để làm khô các chất khí
A. NH3, SO2, CO, Cl2 B. N2, NO2, CO2, CH4, H2 C. NH3, O2, N2, CH4, H2 D. N2, Cl2, O2 , CO2, H2
A.22.
Giả sử H có 3 đồng vị, S có 1 đồng vị, O có 3 đồng vị. Số phân tử H2SO3 có thể có là:
A. 72 B. 90 C. 60 D. 36
A.23.
Than cháy trong oxi tinh khiết và trong không khí có giống nhau không?
A. than cháy trong oxi tinh khiết và trong không khí như nhau
B. than cháy trong oxi tinh khiết mạnh hơn
C. than cháy trong không khí mạnh hơn
D. không xác định được
A.24.
Ozon có rất nhiều ứng dụng trong thực tiễn như: Tẩy trắng thực phẩm, khử trùng nước ăn, khử mùi, chữa sâu răng .v.v... Nguyên nhân dẫn đến ozon có những ứng dụng đó là vì:
A. ozon kém bền B. ozon có tính khử mạnh
C. ozon có tính oxi hóa mạnh D. một nguyên nhân khác
A.25.
Dung dịch H2S trong nước khi để lâu ngày trở nên đục. Hiện tượng này được giải thích như sau
A. H2S bị phân hủy thành H2 và S
B. H2S bị oxi hóa không hoàn toàn thành H2O và S
C. H2S bị oxi hóa hoàn toàn thành H2O và SO2
D. H2S phản ứng với SO2 trong không khí tạo thành H2O và S
A.26.
Cho sắt phản ứng với HNO3 rất loãng thu được NH4NO3, có phương trình ion thu gọn là :
A. 8Fe + 30H+ + 6NO3- ¾® 8Fe3+ + 3NH4NO3 + 9H2O
B. 8Fe + 30HNO3 ¾® 8Fe3+ + 3NH4NO3 + 9H2O
C. 3Fe + 48H+ + 8NO3- ¾® 3Fe2+ + 8NH4+ + 24H2O
D. 8Fe + 30H+ + 3NO3- ¾® 8Fe3+ + 3NH4+ + 9H2O
A.27.
A là một kim loại. Thực hiện các phản ứng theo thứ tự
(A) + O2 ¾® (B) (B) + H2SO4 loãng ¾® (C) + (D) + (E)
(C) + NaOH ¾® (F)¯ + (G) (D) + NaOH ¾® (H)¯ + (G)
(F) + O2 + H2O ¾® (H)
Kim loại A là
A. Zn B. Al C. Mg D. Fe
A.28.
Đốt hỗn hợp bột sắt và iốt dư thu được
A. FeI2 B. FeI3 C. hỗn hợp FeI2 và FeI3 D. không phản ứng.
A.29.
Để loại các khí: SO2; NO2; HF trong khí thải công nghiệp, người ta thường dẫn khí thải đi qua dung dịch nào dưới đây?
A. HCl B. NaCl C. NaOH D. Ca(OH)2
A.30.
Cho khí CO (dư) đi qua ống sứ đựng hỗn hợp X gồm: Al2O3 , MgO , Fe3O4 , CuO nung nóng thu được hỗn hợp rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xáy ra hoàn toàn. Phần không tan Z gồm :
A. Mg, FeO, Cu B. Mg, Fe, Cu C. MgO, Fe, Cu D. MgO, Fe3O4, Cu
A.31.
Có các lọ riêng biệt đựng các dung dịch không màu: AlCl3, ZnCl2, MgCl2, FeSO4, Fe(NO3)3, NaCl. Chỉ dùng dung dịch nào dưới đây để phân biệt các lọ mất nhãn trên?
A. Na2CO3 B. Ba(OH)2 C. NaOH D. NH3
A.32.
Hỗn hợp X chứa K2O, NH4Cl, KHCO3 và BaCl2 có số mol bằng nhau. Cho hỗn hợp X vào nước (dư), đun nóng, dung dịch thu được chứa:
A. KCl, KOH B. KCl C. KCl, KHCO3, BaCl2 D. KCl, KOH, BaCl2
A.33.
Từ các sơ đồ phản ứng sau :
a) X1 + X2 ![]() Ca(OH)2 + H2 b) X3 + X4
Ca(OH)2 + H2 b) X3 + X4 ![]() CaCO3 + Na2CO3 + H2O
CaCO3 + Na2CO3 + H2O
c) X3 + X5 ![]() Fe(OH)3 + NaCl + CO2 d) X6 + X7 + X2
Fe(OH)3 + NaCl + CO2 d) X6 + X7 + X2 ![]() Al(OH)3 + NH3 + NaCl
Al(OH)3 + NH3 + NaCl
Các chất thích hợp với X2, X3, X4, X5 tương ứng là
A. Ca ; NaOH ; Ca(HCO3)2 ; FeCl3 B. H2O ; Ca(HCO3)2 ; NaOH ; FeCl3
C. H2O ; NaHCO3 ; Ca(OH)2 ; FeCl3 D. Ca ; Ca(OH)2 ; NaHCO3 ; FeCl3
A.34.
Cho bột nhôm vào dung dịch chứa AgNO3 và Cu(NO3)2 lắc đều một thời gian thu được chất rắn X1 và dung dịch X2 . Cho X1 tác dụng với dung dịch NaOH dư thu được khí H2 và còn lại hỗn hợp hai kim loại. Cho X2 tác dụng với dung dịch NaOH dư, được kết tủa X3 là hiđroxit của một kim loại. Các chất có trong X1, X2, X3 gồm
A. X1 (Ag, Al) ; X2 (Al(NO3)3) ; X3 (Al(OH)3).
B. X1 (Ag, Cu) ; X2 (Al(NO3)3 ; Cu(NO3)2) ; X3 (Al(OH)3).
C. X1 (Ag, Cu, Al) ; X2 (Al(NO3)3, Cu(NO3)2) ; X3 (Cu(OH)2).
D. X1 (Ag, Cu, Al) ; X2 (Al(NO3)3) ; X3 (Cu(OH)2).
A.35.
Điện phân dung dịch chứa a mol CuSO4, b mol NaCl (với điện cực trơ, màng ngăn xốp). Dung dịch thu được sau phản ứng hoà tan được Al2O3. Quan hệ giữa a và b là:
A. a < 2b hoặc a > 2b B. a < b C. b > 2a hoặc b< 2a D. b ![]() 2a
2a
A.36.
Cho dung dịch X chứa a mol HCO3– và b mol CO32–. Cho dung dịch X tác dụng với dung dịch CaCl2 dư (thí nghiệm 1) và dung dịch Ca(OH)2 dư (thí nghiệm 2), lượng kết tủa thu được ở mỗi thí nghiệm là :
A. a mol B. b mol C. (a+b) mol D. b mol
A.37.
Để xử lí các khí thải công nghiệp là CO, NO, hiđrocacbon, người ta thực hiện giai đoạn 1 là giai đoạn ..............có xúc tác Pt để chuyển hỗn hợp trên thành N2 hay NH3,CO2, hiđrocacbon. Sau đó thực hiện giai đoạn 2 là giai đoạn .................có xúc tác Pt để chuyển hỗn hợp thu được thành khí N2, CO2, H2O và thải ra môi trường.
Cụm từ phù hợp cần điền vào hai chỗ trống trên cho phù hợp lần lượt là :
A. khử hóa, oxi hóa B. khử hóa, khử hóa C. oxi hóa, oxi hóa tiếp tục D. oxi hóa, khử hóa
A.38.
X, Y là 2 nguyên tố kim loại thuộc cùng một phân nhóm chính (nhóm A). Kết luận nào sau đây là đúng đối với X, Y ? (Biết ZX < ZY và ZX + ZY = 32)
A. Bán kính nguyên tử của X > Y B. Năng lượng ion hóa I1 của X < Y
C. X, Y đều có 2 electron lớp ngoài cùng D. Tính kim loại của X > Y
A.39.
Để sản xuất Pb, người ta đốt quặng PbS trong không khí để thu PbO, sau đó dùng chất khử để khử PbO ở nhiệt độ cao. Chất khử thường dùng để khử PbO trong công nghiệp là :
A. C (than cốc) B. Al C. H2 D. Fe
A.40.
Cho một kim loại X vào dung dịch FeCl3 thấy xuất hiện kết tủa đỏ nâu và có khí không màu thoát rA. Cho kim loại Y vào dung dịch muối của kim loại Z thấy kim loại Y tan, sinh ra kim loại Z. Cho kim loại Y vào dung dịch muối của kim loại M thấy không có hiện tượng phản ứng. Cho M vào dung dịch muối của Y thấy M tan, sinh ra kim loại Y. Sắp xếp các kim loại trên theo chiều tăng dần tính khử, ta có dãy:
A. X < Y < Z < M B. Z< Y < M < X C. M < X < Y< Z D. Z < M < Y < X
A.41.
Liên kết chủ yếu trong tinh thể KCl là liên kết :
A. ion B. cộng hóa trị C. kim loại D. cho - nhận
A.42.
Cho a gam kẽm hạt vào một cốc đựng dung dịch H2SO4 2M (dư) ở nhiệt độ thường. Yếu tố nào sau đây không làm biến đổi vận tốc phản ứng ?
A. Thay a gam kẽm hạt bằng a gam kẽm bột.
B. Thay dung dịch H2SO4 2M bằng dung dịch H2SO4 1M.
C. Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50 oC).
D. Dùng thể tích dung dịch H2SO4 2M gấp đôi thể tích ban đầu.
A.43.
Trường hợp nào sau đây không xảy ra phản ứng ?
A. CuO + dung dịch KHSO4 B. CuO + NH3 (tOC)
C. CuO + CO (tOC) D. CuO + dung dịch AgNO3
A.44.
Phát biểu nào sau đây không đúng ?
A. Trong các hợp chất, Pb thường có số oxi hóa là +2, +4.
B. Pb là kim loại nặng và có nhiệt độ nóng chảy thấp (khoảng 330OC).
C. Pb là kim loại có tính khử yếu vì có thế điện cực chuẩn = – 0,13 V.
D. Do có nhiều mức oxi hóa nên Pb được xếp vào loại kim loại chuyển tiếp.
A.45.
Hai ion Mg2+( ZMg = 12) và Na+ ( ZNa = 11) giống nhau ở điểm nào trong các điểm sau ?
A. Bán kính nguyên tử. B. Số electron lớp ngoài cùng.
C. Điện tích hạt nhân. D. Bán kính nguyên tử và điện tích hạt nhân.
A.46.
Cho biết thế điện cực chuẩn của các cặp oxi hóa - khử Mg2+/Mg ; Zn2+/Zn ; Cu2+/Cu ; Ag+/Ag ; Hg2+/Hg lần lượt là : –2,37 V ; –0,76 V ; 0,34 V ; 0,8 V ; và 0,85 V. E0(pin) = 3,22 V là suất điện động chuẩn của pin nào trong số các pin sau ?
A. Mg – Zn B. Mg – Hg C. Zn – Ag D. Zn – Ag
A.47.
Cho a mol Fe vào dung dịch có chứa b mol AgNO3, c mol Cu(NO3)2 thu được một hỗn hợp chất rắn gồm 2 kim loại và dung dịch chứa 2 muối. Kết quả này cho thấy :
A. a = b/2 + c B. a > b/2 +c C. b/2 < a < b/2 + c D. a = b/2
A.48.
Cho phản ứng : 3H2(khí) + Fe2O3 (rắn) ⇄ 2Fe + 3H2O (hơi). Nhận định nào sau đây là đúng?
A. Tăng áp suất cân bằng hóa học chuyển dịch theo chiều thuận
B. Thêm Fe2O3 cân bằng hóa học chuyển dịch theo chiều thuận
C. Nghiền nhỏ Fe2O3 cân bằng hóa học chuyển dịch theo chiều thuận
D. Thêm H2 vào hệ cân bằng hóa học chuyển dịch theo chiều thuận
A.49.
Phương pháp nào sau đây thường được dùng để điều chế Ag từ Ag2S ?
A. Ag2S![]() Na[Ag(CN)2]
Na[Ag(CN)2]![]() Ag B. Ag2S
Ag B. Ag2S![]() AgNO3
AgNO3![]() Ag
Ag
A.50.
Tác hại đối với môi trường của nhóm các chất nào sau đây liệt kê không đúng ?
A. Một số chất phá hủy tầng ozon : CFC, NO, CO, halogen...
B. Một số chất tạo mưa axit : SO2, CO2, NO, NO2, HCl...
C. Một số chất gây hiệu ứng nhà kính : CO2, SO2, C2H6, CH4...
D. Một số chất gây mù quang hóa : O3, SO2, H2S, CH4...
A.51.
Phản ứng nào sau đây xảy ra được ở điều kiện thích hợp ?
A. 2Fe + 3S (dư) ® Fe2S3 B. 2FeCl3 + 3H2S ® Fe2S3 + 6HCl
C. Fe2O3 + CO ® 2FeO + CO2 D. 2FeS + 10H2SO4 ® Fe2(SO4)3 + 9SO2 + 10H2O
A.52.
Fe có lẫn Al, Be, Cr2O3 ở dạng bột. Để tinh chế Fe, ta có thể dùng :
A. Dung dịch H2SO4 loãng B. Dung dịch Ba(OH)2
C. Dung dịch FeCl2 D. HNO3 đặc nguội
A.53.
Sơ đồ phản ứng nào sau đây không tạo ra HBr ?
A. PBr3 + H2O® B. Zn3P2 + H2O → PH3 + Zn(OH)2
C. NaBr (rắn) + H2SO4 đặc ® D. C6H5-CH3 + Br2 ![]() o-BrC6H4-CH3 + HBr
o-BrC6H4-CH3 + HBr
A.54.
Phản ứng nào sau đây không đúng ?
A. CaCl2 + CO2 + H2O ® CaCO3 + 2HCl B. CuCl2 + H2S ® CuS + 2HCl
C. NaHSO4 + Na2CO3 ® Na2SO4 + NaHCO3 D. BaSO3 + 2HCl ® BaCl2 + SO2 + H2O
A.55.
Cho các phản ứng sau: 2SO2 (k) + O2 (k) ⇆ 2SO3 (k) có hằng số cân bằng K1
SO2 (k) + ½ O2 (k) ⇆ SO3 (k) có hằng số cân bằng K2
2SO3 (k) ⇆ 2SO2 (k) + O2 (k) có hằng số cân bằng K3
Mối liên hệ giữa các hằng số cân bằng nào sau đây không đúng?
A.56.
Hai dung dịch chứa hai chất điện li AB và CD (A và C đều có số oxi hóa +1) có cùng nồng độ. Một chất điện li mạnh, một chất điện li yếu. Phương pháp nào sau đây có thể phân biệt được chúng ?
A. Dùng giấy quỳ tím. B. Dùng máy đo pH.
C. Dùng dụng cụ đo độ dẫn điện. D. Điện phân từng dung dịch.
A.57.
Phát biểu nào dưới đây về quá trình điện phân sản xuất Al là không đúng ?
A. Cần tinh chế quặng boxit, do trong quặng ngoài thành phần chính là Al2O3.2H2O, còn có tạp chất như Fe2O3 và SiO2.
B. Từ 1 tấn quặng boxit (chứa 60% Al2O3) có thể điều chế được gần 0,318 tấn Al, nếu hiệu suất quá trình là 100%.
C. Sản xuất 2,7 tấn Al, tiêu hao 0,9 tấn C làm anot, nếu các quá trình là hoàn toàn và sản phẩm oxi hóa anot chỉ là CO2.
D. Criolit được sử dụng trong sản xuất để hạ nhiệt độ nóng chảy, tăng độ dẫn điện và ngăn cản Al bị oxi hóa bởi không khí.
A.58.
Có bốn thanh sắt được đặt tiếp xúc với những kim loại khác nhau và nhúng trong các dung dịch HCl như hình vẽ dưới đây.
Thanh sắt bị hòa tan chậm nhất sẽ là thanh được đặt tiếp xúc với :
A. Zn. B. Sn. C. Ni. D. Cu.
A.59.
Để phân biệt bốn bình khí mất nhãn chứa CH4, N2, H2 và CO người ta cho các mẫu thử lần lượt qua CuO đốt nóng, CuSO4 khan và bình chứa dung dịch Ca(OH)2. Sau thí nghiệm thấy mẫu (1) chỉ làm CuSO4 đổi qua màu xanh; mẫu (2) chỉ tạo kết tủa trắng ở bình chứa nước vôi; mẫu (3) tạo hiện tượng ở cả hai bình này, còn mẫu (4) không tạo hiện tượng gì. Các mẫu (1), (2), (3) và (4) lần lượt là :
|
| (1) | (2) | (3) | (4) |
| (1) | (2) | (3) | (4) |
| A. | CH4 | N2 | H2 | CO | C. | H2 | CO | CH4 | N2 |
| B. | CO | CH4 | N2 | H2 | D. | N2 | H2 | CO | CH4 |
A.60.
Xementit phản ứng với dung dịch HNO3 (đặc, nóng), theo phương trình : Fe3C + HNO3 ® Fe(NO3)3 + CO2 + NO2 + H2O
Số mol HNO3 cần để hòa tan hoàn toàn 0,01 mol Fe3C là :
A. 0,01 mol. B. 0,09 mol. C. 0,16 mol. D. 0,22 mol.
A.61.
Xét các phản ứng :
(X) ZnCO3.ZnS + 3/2O2 ![]() 2ZnO + CO2 + SO2 (Y) ZnO + CO
2ZnO + CO2 + SO2 (Y) ZnO + CO ![]() Zn + CO2
Zn + CO2
(Z) ZnO + H2SO4 ![]() ZnSO4 + H2 (T) ZnSO4 + H2O
ZnSO4 + H2 (T) ZnSO4 + H2O![]() Zn + 1/2O2 + H2SO4
Zn + 1/2O2 + H2SO4
Quá trình điều chế Zn từ quặng ZnCO3.ZnS bằng phương pháp điện luyện đã không dùng phản ứng :
A. X. B. Y. C. Z. D. T.
A.62.
Chọn câu đúng trong các nhận định sau :
A. HNO3 là chất OXH mạnh nhất trong tất cả các chất
B. HNO3 là chất lỏng, không màu, tan có hạn trong nước
C. HNO3 có tính OXH mạnh cả khi đặc , loãng và rất loãng
D. HNO3 là một axit mạnh nhất trong tất cả các axit
A.63.
Chọn những dãy ion có thể cùng tồn tại trong 1 dung dịch:
A. H+ ; NO3- ; Al3+ ; Ba2+ B. Al3+ ; Ca2+ ; SO32- ; Cl-
C. Mg2+ ; CO32- ; K+ ; SO42- D. Pb2+ ; Cl- ; Ag+ ; NO3-
A.64.
Cho m(g) Fe vào dung dịch HNO3 loãng thì không có khí thoát ra. Kết thúc phản ứng lọc được a (g) Fe ra khỏi dung dịch X. Dung dịch X chứa :
A. Fe2+ ; NO3- ; NH4+ B. Fe3+ ; NO3- ; Fe2+ ; NH4+
C. Fe3+ ; NO3- ; Fe2+ D. Fe3+ ; Fe2+ ; NH4+
A.65.
Câu nào sai trong số các nhận định sau :
A. Chất rắn chứa các ion Mg2+, Cl-, Br- thì tan được trong nước
B. Dung dịch chứa NH4+, NO3-, K+ có pH>7
C. Chất rắn chứa các ion Fe2+, S2-, Zn2+ tan được trong dung dịch HCl
D. Chất rắn chứa các ion Ba2+, Ca2+, SO42- không ta được trong dung dịch KOH
A.66.
Chọn câu nhận định đúng
A. Dung dịch amoniac có tính kiềm yếu và có khả năng kết hợp với các cation Zn2+, Ag+… tạo ra các ion phức
B. Thuốc thử để nhận biết dung dịch muối amoni là giấy quì tím
C. NH3 chỉ có tính khử mà không có tính OXH vì phân tử phân cực mạnh
D. Đốt cháy NH3 trong không khí thu được NO và H2O
A.67.
Hỗn hợp X chứa Na2O, NH4HCO3 và BaCl2 có số mol mỗi chất đều bằng nhau. Cho hỗn hợp X vào H2O (dư), đun nóng, dung dịch thu được chứa :
A. NaCl B. NaCl, NaOH C. NaCl, NaHCO3, BaCl2 D. NaCl, NaOH, BaCl2
A.68.
Cho a mol NaOH tác dụng với a mol NaHCO3 thì dung dịch thu được có giá trị pH là :
A. pH < 7 B. pH > 7 C. pH = 7 D. pH = 14
A.69.
Cho từ từ 2a mol NaHSO4 vào dung dịch có chứa a mol NaOH + a mol NaAlO2 thì hiện tượng phản ứng là :
A. Không có phản ứng xảy ra. B. Có phản ứng xảy ra nhưng không rõ hiện tượng.
C. Tạo kết tủa sau đó một phần kết tủa tan. D. Xuất hiện kết tủa keo màu trắng.
A.70.
Cho phản ứng : Cu2S + HNO3 ® CuSO4 + Cu(NO3)2 + NO2 + H2O .Tổng hệ số các chất tham gia phản ứng là :
A. 12 B. 15 C. 13 D. 16
A.71.
Cho phản ứng hoá học sau: MxOy + HNO3 ® M(NO3)n + NO + H2O. Hệ số cân bằng của phản ứng lần lượt là:
A. 3 , (nx- 2y) , 2x , (2nx- y) , (nx- y) B. 6 , (2nx- y) , x , (nx- y) , (3nx- y)
C. 3 , (4nx- 2y) , 3x , (nx- 2y) , (2nx- y) D. 2 , (3nx- 3y) , 2x , (2nx- 2y) , (2nx- 2y)
A.72.
Trong công nghiệp, để điều chế khí than ướt, người ta thổi hơi nước qua than đá đang nóng đỏ. Phản ứng hoá học xảy ra như sau : C (r) + H2O (k) ![]() CO(k) +H2(k) DH= 131kJ
CO(k) +H2(k) DH= 131kJ
Điều khẳng định nào sau đây là đúng?
A. Tăng áp suất chung của hệ làm cân bằng không thay đổi.
B. Tăng nhiệt độ của hệ làm cân bằng chuyển sang chiều thuận.
C. Dùng chất xúc tác làm cân bằng chuyển sang chiều thuận.
D. Tăng nồng độ hiđro làm cân bằng chuyển sang chiều thuận.
A.73.
Clo tác dụng với nước theo phương trình hoá học sau: Cl2(k) + H2O(l) ![]() HOCl + HCl
HOCl + HCl
Hai sản phẩm tạo ra đều tan tốt trong nước tạo thành dd. Ngoài ra một lượng đáng kể khí clo tan trong nước tạo thành dd có màu vàng lục nhạt gọi là nước clo. Hãy chọn lí do sai: Nước clo dần dần bị mất màu theo thời gian, không bảo quản được lâu vì:
A. Clo là chất khí dễ bay ra khỏi dd. B. Axit hipoclorơ (HOCl) là hợp chất không bền.
C. Hidroclorua (HCl) là chất khí dễ bay hơi. D. phản ứng hoá học trên là thuận nghịch.
A.74.
Cho các phản ứng oxi hoá- khử sau:
3I2 + 3H2O ® HIO3 + 5HI (1) HgO ®2Hg + O2 (2)
4K2SO3 ® 3K2SO4 + K2S (3) NH4NO3 ® N2O + 2H2O (4)
2KClO3 ® 2KCl + 3O2 (5) 3NO2 + H2O ® 2HNO3 + NO (6)
4HClO4® 2Cl2 + 7O2 + 2H2O (7) 2H2O2 ®2H2O + O2 (8)
Trong số các phản ứng oxi hoá- khử trên, số phản ứng oxi hoá- khử nội phtử là
A. 2 B. 3 C. 4 D. 5
A.75.
Cho các phương trình hoá học sau đây:
A. Al4C3 +12H2O®4Al(OH)3 + 3CH4 B. 2Na + 2H2O ® 2NaOH + H2
C. C2H2 + H2O ![]() CH3CHO D. C2H5Cl+H2O
CH3CHO D. C2H5Cl+H2O![]() C2H5OH +HCl
C2H5OH +HCl
E. NaH + H2O ® NaOH + H2 F. 2F2 + 2H2O ® 4HF + O2
Có bao nhiêu phản ứng hoá học trong số các phản ứng trên, trong đó H2O đóng vai trò chất oxi hóa hay chất khử?
A. 1 B. 2 C. 3 D. 4
A.76.
Khi làm thí nghiệm với photpho trắng, cần có chú ý nào sau đây?
A. Cầm P trắng bằng tay có đeo găng.
B. Dùng cặp gắp nhanh mẩu P trắng ra khỏi lọ và ngâm ngay vào chậu đựng đầy nước khi chưa dùng đến.
C. Tránh cho P trắng tiếp xúc với nước.
D. Có thể để P trắng ngoài không khí.
A.77.
Lời giải thích đúng cho hiện tượng sau: Khi mở bình nước ngọt có ga lại có nhiều bóng khí thoát ra vì:
A. Trong sản xuất nước ngọt người ta dùng áp lực lớn để ép khí CO2 hoà tan vào nước, sau đó nạp vào bình và đóng kín lại, khi mở bình nước ngọt áp suất ngoài không khí thấp hơn áp suất trong bình nước ngọt nên khí CO2 bay vào không khí.
B. Vì CO2 tan trong nước, khi sản xuất nước ngọt thì khí CO2 trong không khí tan vào nước ngọt. Khi mở bình nước ngọt ra lập tức khí CO2 bay vào không khí.
C. Vì các chất trong nước ngọt phản ứng với nhau sinh ra CO2, khi mở bình nước ngọt ra thì khí CO2 bay vào không khí.
D. Do trong quá trình sản xuất nước ngọt các khí trong không khí đã hoà tan vào nước ngọt. Vì vậy khi mở bình nước ngọt ra thì các khí này thoát ra ngoài không khí do có sự chênh lệch áp suất giữa không khí và trong bình nước ngọt.
A.78.
Có 3 gói bột rắn là Fe , hỗn hợp Fe2O3 + FeO ; hỗn hợp Fe + Fe2O3 để phân biệt chúng ta có thể dùng :
A. dung dịch HNO3 và dung dịch nước Cl2 B. Dung dịch HCl và dung dịch NaOH
C. dung dịch HNO3 và dung dịch NaOH D. nước Cl2 và dung dịch NaOH
BÀI TẬP VÔ CƠ
B.1.
Cho 5,7 gam hỗn hợp bột P gồm Mg, Al, Zn, Cu tác dụng hoàn toàn với oxi dư thu được hỗn hợp rắn Q có khối lượng là 8,1 gam. Thể tích tối thiểu dung dịch HCl 1M cần dùng để hoà tan hoàn toàn Q là
A. 180 ml B. 270 ml C. 300 ml D. 360 ml
B.2.
Cho một lượng bột CaCO3 tác dụng hoàn toàn với dung dịch HCl 32,85% sau phản ứng thu được dung dịch X trong đó nồng độ HCl còn lại là 24,20%. Nồng độ % CaCl2 trong dung dịch sau phản ứng
A. 10,35% B. 12,35% C. 11,35% D. 8,54%
B.3.
Hoà tan hỗn hợp X gồm Cu và Fe2O3 trong 400 ml dung dịch HCl a mol/lít được dung dịch Y và còn lại 1 gam đồng không tan. Nhúng thanh Mg vào dung dịch Y, sau khi phản ứng xong, nhấc thanh Mg ra thấy khối lượng tăng 4 gam so với ban đầu và có 1,12 lít khí H2 (đktc) bay rA.(Giả thiết toàn bộ lượng kim loại thoát ra đều bám vào thanh Mg). Khối lượng của Cu trong X và giá trị của a là
A. 1,0g và 1M B. 4,2g và 1M. C. 3,2g và 2M. D. 4,8g và 2M.
B.4.
Hoà tan 14,2 gam hỗn hợp X gồm MgCO3 và một muối cacbonat của kim loại M vào một lượng vừa đủ axit HCl 7,3% thu được dung dịch Y và 3,36 lít khí CO2 (đktc). Nồng độ MgCl2 trong Y là 6,028%. Cho dung dịch NaOH dư vào dung dịch Y, lọc lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi thì thu được m gam chấy rắn. Giá trị của m bằng
A. 12,0g B. 10,4g C. 8,0g D. 7,6g
B.5.
Hoà tan hoàn toàn 5,94g Al vào dung dịch NaOH dư thu được khí X. Cho 1,896g KMnO4 tác dụng hết với axit HCl được khí Y. Nhiệt phân hoàn toàn 12,25g KClO3 có xúc tác thu được khí Z. Cho toàn bộ 3 khí Z, Y, Z trên vào bình kín rồi đốt cháy để phản ứng xảy ra hoàn toàn, sau đó đưa bình về nhiệt độ thường, thu được dung dịch T. Nồng độ phần trăm chất tan trong T là
A. 18,85% B. 28,85% C. 24,24% D. 31,65%
B.6.
Cho phản ứng N2 + 3H2 ![]() 2NH3 . Khi cân bằng được thiết lập, ta có nồng độ cân bằng của các chất như sau : [N2] = 3 mol/l, [H2] = 9 mol/l, [NH3] = 4 mol/l. Vậy nồng độ ban đầu của N2 và H2 là
2NH3 . Khi cân bằng được thiết lập, ta có nồng độ cân bằng của các chất như sau : [N2] = 3 mol/l, [H2] = 9 mol/l, [NH3] = 4 mol/l. Vậy nồng độ ban đầu của N2 và H2 là
A. [N2] = 7 mol/l, [H2] = 12 mol/l B. [N2] = 5 mol/l, [H2] = 15 mol/l
C. [N2] = 5 mol/l, [H2] = 12 mol/l D. [N2] = 9 mol/l, [H2] = 15 mol/l
B.7.
Cho 200 ml dung dịch X chứa các ion NH4+ , K+ , SO42- , Cl- với nồng độ tương ứng là 0,5M , 0,1M , 0,25M , 0,1M. Biết rằng dung dịch X được điều chế bằng cách hoà tan 2 muối vào nướC. Khối lượng của 2 muối được lấy là
A. 6,6g (NH4)2SO4 và 7,45g KCl B. 6,6g (NH4)2SO4 và 1,49g KCl
C. 8,7g K2SO4 và 5,35g NH4Cl D. 3,48g K2SO4 và 1,07g NH4Cl
B.8.
Nung 44 gam hỗn hợp X gồm Cu và Cu(NO3)2 trong bình kín cho đến khi các phản ứng xảy ra hoàn toàn thu được chất rắn Y. Chất rắn Y phản ứng vừa đủ với 600 ml dung dịch H2SO4 0,5 M (Y tan hết). Khối lượng Cu và Cu(NO3)2 có trong hỗn hợp X là
A. 6,4 g Cu; 37,6 g Cu(NO3)2 B. 9,6 g Cu; 34,4 g Cu(NO3)2
C. 8,8 g Cu; 35,2 g Cu(NO3)2 D. 12,4 g Cu; 31,6 g Cu(NO3)2
B.9.
Hai bình A, B có thể tích bằng nhau. Bình A chứa 1 mol khí Cl2, bình B chứa 1 mol khí O2. Cho vào mỗi bình 2,4 gam bột kim loại M có hoá trị không đổi. Đun nóng 2 bình để các phản ứng xảy ra hoàn toàn rồi đưa 2 bình về nhiệt độ ban đầu, nhận thấy áp suất khí trong 2 bình PA : PB = 1,8 : 1,9. Kim loại M là
A. Zn B. Ca C. Mg D. Ba
B.10.
Hoà tan 17 gam hỗn hợp NaOH, KOH, Ca(OH)2 vào nước được 500 gam dung dịch X. Để trung hoà 50 gam dung dịch X cần dùng 40 gam dung dịch HCl 3,65%. Cô cạn dung dịch sau khi trung hoà thu được khối lượng muối khan là
A. 3,16 gam B. 2,44 gam C. 1,58 gam D. 1,22 gam
B.11.
Điện phân dung dịch chứa hỗn hợp 2 muối CuCl2 và Cu(NO3)3 một thời gian, ở anot của bình điện phân thoát ra 448 ml hỗn hợp khí (đktc) có tỉ khối so với H2 bằng 25,75 và có m gam kim loại Cu bám trên catot. Giá trị của m bằng
A. 0,64 gam B. 1,28 gam C. 1,92 gam D. 2,56 gam
B.12.
Điện phân nóng chảy a gam muối halogenua của kim loại M, thu được 1,6 gam M ở Catot và 0,896 lít khí (đktc) ở Anot. Mặt khác dung dịch chứa a gam muối halogenua nói trên tác dụng với AgNO3 dư thu được 11,48 gam kết tủA. Công thức muối halogenua là
A. Canxi florua B. Magie clorua C. Canxi clorua D. Magie bromua
B.13.
Hoà tan hết hỗn hợp FeS2, FeCO3 bằng dung dịch HNO3 đặc, nóng được dung dịch X và 4,48 lít (đktc) hỗn hợp khí Y có tỉ khối so với hiđro bằng 22,75. Hấp thụ toàn bộ khí Y vào 300 ml dung dịch NaOH 1 M được dung dịch Z. Các chất tan trong Z gồm
A. NaHCO3, Na2CO3, NaNO3, NaNO2 B. Na2CO3, NaNO3, NaNO2, NaOH
C. NaHCO3, NaNO3, Na2CO3 D. Na2CO3, NaNO3, NaOH
B.14.
Hai nguyên tố X, Y thuộc 2 phân nhóm chính liên tiếp trong bảng tuần hoàn. Tổng số electron trong 2 nguyên tử X, Y bằng 19. Phân tử hợp chất XxYy có tổng số proton bằng 70. Công thức phân tử hợp chất là
A. Mg3N2 B. CaC2 C. Al4C3 D. Na2O
B.15.
Đốt cháy m gam đồng (II) sunfua trong khí oxi dư thu được chất rắn X có khối lượng bằng (m – 4,8) g Nung X trong khí NH3 dư tới khối lượng không đổi được chất rắn Y. Hoà tan Y trong dung dịch HNO3 loãng dư, thu được V lít khí Z (đktc) không màu, nặng hơn oxi. Giá trị của m (gam) và V (lít) là
A. 19,2g và 1,12 lit B. 28,8g và 1,68 lit C. 24,0g và 1,68 lit D. 28,8g và 1,12 lit
B.16.
Cho 4,48 lít khí CO (đktc) đi từ từ qua ống sứ nung nóng đựng 23,2 gam Fe3O4. Sau khi dừng phản ứng, thu được chất rắn X và khí Y có tỉ khối so với hiđro bằng 18. Hoà tan X trong dung dịch HNO3 loãng dư thu được V lít khí NO (đktc). Khối lượng chất rắn X và thể tích khí NO thu được là
A. 21,6g và 2,24 lit B. 20,0g và 3,36 lit C. 20,8g và 2,8 lit D. 21,6g và 3,36 lit
B.17.
Khử m gam Fe2O3 bằng CO một thời gian được chất rắn X. Hoà tan hết chất rắn X trong dung dịch HNO3 loãng, thu được 0,224 lít khí NO (là sản phẩm khử duy nhất ở đktc). Cô cạn dung dịch sau phản ứng được 18,15 gam muối khan. Hiệu suất của phản ứng khử oxit sắt bằng
A. 26,67 % B. 30,25 % C. 13,33 % D. 25,00 %
B.18.
Nhỏ từ từ 3V1 ml dung dịch Ba(OH)2 (ddX) vào V1 ml dung dịch Al2(SO4)3 (ddY) thì phản ứng vừa đủ và ta thu được kết tủa lớn nhất là m gam.. Nếu trộn V2 ml dung dịch X ở trên vào V1 ml dung dịch Y thì kết tủa thu được có khối lượng bằng 0,9m gam. So sánh tỉ lệ V2 / V1 thấy
A. V2 / V1 = 2,7 hoặc V2 / V1 = 3,55 B. V2 / V1 = 2,5 hoặc V2 / V1 = 3,25
C. V2 / V1 = 1,7 hoặc V2 / V1 = 3,75 D. V2 / V1 = 2,5 hoặc V2 / V1 = 3,55
B.19.
Nhúng thanh kim loại R (hoá trị II)có khối lượng 9,6g vào dung dịch chứa 0,24 mol Fe(NO3)3. Sau một thời gian lấy thanh kim loại ra, dung dịch thu được có khối lượng bằng khối lượng dung dịch ban đầu, thanh kim loại sau đó đem hoà tan bằng dd HCl dư thì thu được 6,272 lit H2(đktc). Kim loại R là
A. Zn B. Mg C. Ni D. Cd
B.20.
Cho 6,94 gam hỗn hợp gồm FexOy và Al hoà tan hoàn toàn trong 100 ml dung dịch H2SO4 1,8 M, tạo ra 0,672 lít H2 (đktc). Biết khối lượng H2SO4 đã lấy dư 20% so với lượng cần thiết cho phản ứng . FexOy là
A. FeO B. Fe2O3 C. Fe3O4 D. không xác định
B.21.
Điện phân dung dịch CuCl2 với điện cức trơ, sau một thời gian thu được 0,32 gam Cu ở catot và một lượng khí X ở anot. Hấp thụ toàn bộ lượng khí x trên vào 200 ml dung dịch NaOH ( ở nhiệt độ thường ). Sau phản ứng, nồng độ NaOH còn lại là 0,05M (giả thiết thể tích dung dịch không thay đổi). Nồng độ ban đầu của dung dịch NaOH là
A. 0,15M B. 0,2M C. 0,1M D. 0,05M.
B.22.
Một hỗn hợp X có khối lượng m gam gồm Ba và Al. Cho m gam X tác dụng với nước dư, thu được 8,96 lít khí H2.Cho m gam X tác dụng với dung dịch Ba(OH)2 dư thu được 22,4 lít khí H2. m có giá trị là:
A. 29,9 gam B. 27,2 gam C. 16,8 gam D. 24,6 gam
B.23.
Cho 3,04 gam hỗn hợp X gồm FeO, Fe3O4, Fe2O3. Để khử hoàn toàn hỗn hợp X thì cần 0,1 gam hiđro. Mặt khác, hoà tan hỗn hợp X trong H2SO4 đặc, nóng thì thể tích khí SO2 (là sản phẩm khử duy nhất ở đktc) là
A. 112 ml B. 224 ml C. 336 ml D. 448 ml
B.24.
Cho 20 gam S vào một bình có dung tích bằng 44,8 lít chứa O2 (ở đktc), thể tích chất rắn không đáng kể. Nung bình cho đến khi phản ứng hoàn toàn, áp suất trong bình khi trở về 0oC là (cho S = 32)
A. 2atm B. 2,1atm C. 1atm D. 1,2atm
B.25.
Hoà tan hoàn toàn 16 gam hỗn hợp Mg và Fe bằng dung dịch H2SO4 loãng vừa đủ. Sau phản ứng thấy khối lượng dung dịch tăng thêm 15,2 gam so với ban đầu. Khối lượng muối khan thu được khi cô cạn dung dịch sau phản ứng là
A. 53,6 gam B. 54,4 gam C. 92 gam D. 92,8 gam
B.26.
Cho 11,6 gam muối FeCO3 tác dụng vừa đủ với dung dịch HNO3, được hỗn hợp khí CO2, NO và dung dịch X. Khi thêm dung dịch HCl (dư) vào dung dịch X, thì dung dịch thu được hoà tan tối đa bao nhiêu gam bột đồng kim loại, biết rằng có khí NO bay rA.
A. 14,4 gam B. 7,2 gam C. 16 gam D. 32 gam
B.27.
Cho 2,2 gam hỗn hợp Al và Fe trong đó số nguyên tử Al gấp đôi số nguyên tử Fe, tác dụng với lượng dư dung dịch muối clorua
của kim loại M ( M có hoá trị II trong muối và đứng sau Al, Fe trong dãy điện hoá) thu được 5,12 gam chất rắn. Công thức muối của kim loại M là:
A. Ni B. Pb C. Cu D. Hg
B.28.
Hoà tan 10 gam hỗn hợp Cu2S và CuS bằng 200 ml dung dịch KMnO4 0,75M trong môi trường axit H2SO4. Sau khi đun sôi để đuổi hết khí SO2 sinh ra, lượng KMnO4 còn dư phản ứng vừa hết với 175 ml dung dịch FeSO4 1M. Khối lượng CuS trong hỗn hợp ban đầu là:
A. 4 gam B. 5 gam C. 6 gam D. 7 gam
B.29.
Trộn lẫn 30 ml dung dịch HCl a mol/l với 50 ml dung dịch Ba(OH)2 có pH = 12,5 được dung dịch X có pH = 10. Nồng độ mol của dung dịch HCl a có giá trị bằng:
A. 0,0524M B. 0,5240M C. 0,2524M D. 0,0254M
B.30.
Đốt cháy hỗn hợp khí X gồm H2S và 6,72 lít khí O2. Làm lạnh hỗn hợp sau phản ứng để ngưng tụ hết hơi nước thấy còn lại 5,6 lít khí Y. Thể tích khí SO2 trong Y là (biết phản ứng xảy ra hoàn toàn, các thể tích khí đo ở đktc):
A. 4,48 lit B. 3,36 lít C. 3,36 lít hoặc 2,24 lít D. 4,48 lit hoặc 2,24 lít
B.31.
Hoà tan 14,3 gam Na2CO3.10H2O vào 85,7 gam nước được dung dịch X. Cho rằng khối lượng riêng của nước là 1g/ml và thể tích của nước là thể tích dung dịch. Nồng độ % và khối lượng riêng của dung dịch X lần lượt bằng :
A. 5,3 % và 1,06 g/ml B. 5,3 % và 1,17 g/ml
C. 14,3 % và 1,06 g/ml D. 14,3 % và 1,17 g/ml
B.32.
Một hỗn hợp gồm Al2(SO4)3 và K2SO4, trong đó số nguyên tử oxi chiếm 20/31 tổng số nguyên tử có trong hỗn hợp. Hoà tan hỗn hợp trên vào nước rồi cho tác dụng với dung dịch BaCl2 dư, hỏi khối lượng kết tủa thu được gấp bao nhiêu lần khối lượng hỗn hợp ban đầu:
A. 1,488 lần B. 1,588 lần C. 1,688 lần D. 1,788 lần
B.33.
Cho một lượng bột CaCO3 tác dụng hoàn toàn với dung dịch HCl 32,85%, sau phản ứng thu được dung dịch X trong đó nồng độ HCl còn lại là 24,2% và CaCl2 là a%. Giá trị phù hợp của a là:
A. 10,51% B. 11,51% C. 11,09% D. 10,09%
B.34.
Cho một luồng khí CO đi qua ống sứ đựng 0,04 mol hỗn hợp X gồm FeO và Fe2O3 đốt nóng. Kết thúc thí nghiệm, thu được hỗn hợp Y gồm 4 chất, nặng 4,784 gam. Khí đi ra khỏi ống sứ được hấp thụ vào dung dịch Ca(OH)2 dư thì thu được 4,6 gam kết tủA. Phần trăm khối lượng của FeO trong X là:
A. 10,40% B. 13,04% C. 89,60% D. 86,96%
B.35.
Cho 13,92 gam oxit sắt từ tác dụng với dung dịch HNO3 thu được 0,448 lít khí NxOy (đktc). Khối lượng HNO3 đã tham gia phản ứng là:
A. 34,02 gam B. 35,28 gam C. 11,34 gam D. 31,50 gam
B.36.
Cho 18,56 gam một oxit sắt tác dụng hết với dung dịch HNO3 tạo ra 0,224 lít khí(đktc) một oxit của nitơ. Công thức của oxit sắt và oxit nitơ lần lượt là:
A. Fe2O3 và N2O B. Fe3O4 và NO2 C. Fe2O3 và NO D. Fe3O4 và N2O
B.37.
Chia dung dịch có hoà tan 4,14 gam muối R2CO3 (R là một kim loại kiềm) thành 2 phần bằng nhau. Cho 160 ml dung dịch HCl 0,2M vào phần 1 thì sau phản ứng axit vẫn còn dư. Cho dung dịch BaCl2 vào phần 2, lọc được 2,561 gam kết tủA. R2CO3 là muối nào sau đây, biết các phản ứng xảy ra hoàn toàn ?
A. Rb2CO3 B. Cs2CO3 C. Na2CO3 D. K2CO3
B.38.
Cho 20,7 gam hỗn hợp CaCO3 và K2CO3 phản ứng hết với dung dịch HCl dư, thu được khí Y. Sục toàn bộ khí Y từ từ vào dung dịch chỉ chứa 0,18 mol Ba(OH)2, thu được m gam kết tủA. Hỏi m có giá trị trong khoảng nào:
A. 35,46 ≥ m ≥ 29,55 B. 35,46 ≥ m > 29,55
C. 35,46 ≥ m ≥ 30,14 D. 35,46 ≥ m > 0
B.39.
Hỗn hợp R gồm Fe2O3, CuO, CaO có tỉ lệ số mol tương ứng là 1:2:3. Dẫn 14 lít khí CO (đktc) đi vào ống sứ đựng R nung nóng đến phản ứng hoàn toàn, được khí T có tỉ khối so với hiđro bằng 20,4 và chất rắn X. Phần trăm khối lượng các chất rắn trong X:
A. 27,45% Fe ; 31,37% Cu ; 41,18% CaO B. 41,18% Fe ; 31,37% Cu ; 27,45% CaO
C. 35,56% Fe ; 31,11% Cu ; 33,33% Ca D. 31,11% Fe ; 35,56% Cu ; 33,33% Ca
B.40.
Cho 3,84 gam hỗn hợp oxit sắt vào bình kín chứa 2,912 lít khí CO (ở đktc) nung nóng đến phản ứng hoàn toàn được Fe và khí A có tỉ khối so với H2 bằng 18. Mặt khác, hoà tan hoàn toàn 3,84 gam hỗn hợp trên bằng H2SO4 đặc nóng, dư thì thu được V ml khí SO2 ( ở đktc). V có giá trị là:
A. 112 ml B. 224 ml C. 336 ml D. 448 ml
B.41.
Hoà tan hoàn toàn 9,94 gam hỗn hợp Al, Fe, Cu trong dung dịch HNO3 loãng dư, thấy thoát ra 3,584 lít khí NO (ở đktc ; là sản phẩm khử duy nhất). Tổng khối lượng muối tạo thành là:
A. 39,7g B. 37,3g C. 29,7g D. 27,3g
B.42.
Hoà tan hoàn toàn 12 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 dư, kết thúc thí nghiệm thu được 6,72 lít (đktc) hỗn hợp khí Y gồm NO và NO2 có khối lượng 12,2 gam. Khối lượng muối nitrat sinh ra là:
A. 30,6 gam B. 39,9 gam C. 43,0 gam D. 55,4 gam
B.43.
Nhiệt phân hoàn toàn hỗn hợp gồm x mol AgNO3 và y mol Cu(NO3)2 được hỗn hợp khí có M = 42,5 đvC.Tỷ số x/y là:
A. 1 B. 2 C. 3 D. 4
B.44.
Điện phân dung dịch CuSO4 với anot bằng đồng, cường độ dòng là 5 A, trong thời gian 9650 giây. Điều nào sau đây đúng ?
A. Khối lượng đồng thu được ở catot là 16 g.
B. Khối lượng khí oxi thu được ở anot là 4 g.
C. Nồng độ CuSO4 giảm dần trong quá trình điện phân.
D. Phương trình điện phân là : 2CuSO4 + 2H2O ® 2Cu + 2H2SO4 + O2
B.45.
Dung dịch A chứa 0,01 mol Fe(NO3)3 và 0,15 mol HCl có khả năng hòa tan tối đa bao nhiêu gam Cu kim loại? (Biết NO là sản phẩm khử duy nhất)
A. 2,88 gam. B. 3,92 gam. C. 3,2 gam. D. 5,12 gam.
B.46.
Cho một a gam nhôm tác dụng với b gam Fe2O3 thu được hỗn hợp A. Hòa tan A trong HNO3 dư, thu được 2,24 lít (đktc) một khí không mầu, hóa nâu trong không khí. Khối lượng nhôm đã dùng là
A. 2,7 gam. B. 5,4 gam. C. 4,0 gam. D. 1,35 gam.
B.47.
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Fe, Zn bằng dung dịch HCl dư. Dung dịch thu được sau phản ứng tăng lên so với ban đầu (m – 2) gam. Khối lượng ( gam) muối clorua tạo thành trong dung dịch là
A. m +73. B. m + 35,5. C. m + 36,5. D. m + 71.
B.48.
Trộn 3 dung dịch HCl 0,3M; H2SO4 0,2M và H3PO4 0,1M với những thể tích bằng nhau thu được dung dịch X. Dung dịch Y gồm NaOH 0,1M và Ba(OH)2 0,2M. Để trung hòa hết 300ml dung dịch X cần vừa đủ Vml dung dịch Y. Giá trị của V là
A. 1000. B. 333,3. C. 600. D. 200.
B.49.
Cho 1,0 gam bột sắt tiếp xúc với oxi một thời gian thấy khối lượng bột vượt quá 1,41 gam. Nếu chỉ tạo thành một oxit sắt duy nhất thì oxit đó là
A. Fe3O4 hoặc Fe2O3. B. FeO. C. Fe3O4. D. Fe2O3.
B.50.
Cho 18,5 gam hỗn hợp X gồm Fe, Fe3O4 tác dụng với 200ml dung dịch HNO3 loãng, đun nóng và khuấy đều. Sau khi phản ứng xảy ra hoàn toàn được 2,24 lít khí NO duy nhất (đktc), dung dịch Y và còn lại 1,46 gam kim loại. Khối lượng muối trong Y và nồng độ mol của dung dịch HNO3 là
A. 65,34 gam; 2,7M. B. 65,34 gam; 3,2M. C. 48,6 gam; 2,7M. D. 48,6 gam; 3,2M.
B.51.
Cho 28,8 gam bột Cu vào 200ml hỗn hợp axit HNO31,0M và H2SO4 0,5M thấy thoát ra V lít khí NO (sản phẩm khử duy nhất, đo ở đktc). Giá trị của V là
A. 2,24 lít. B. 6,72 lit. C. 4,48 lít. D. 1,12 lit.
B.52.
Hòa tan 4,0 gam hỗn hợp gồm Fe và kim loại X ( hóa trị II, đứng trước hidro trong dãy điện hóa) bằng dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc). Để hòa tan 2,4 gam X thì cần dùng chưa đến 250ml dung dịch HCl 1M. Kim loai X là
A. Ba B. Zn. C. Ca D. Mg.
B.53.
Cho x gam hỗn hợp bột các kim loại Ni và Cu vào dung dịch AgNO3 dư, khuấy kĩ cho đến khi phản ứng kết thúc thu được 54 gam kim loại. Mặt khác cũng cho x gam hỗn hợp bột kim loại trên vào dung dịch CuSO4 dư, khuấy kĩ cho đến khi phản ứng kết thúc thu được (x + 0,5) gam kim loại. Giá trị của x là
A. 5,9. B. 9,6. C. 15,5. D. 32,4.
B.54.
Nung m gam bột sắt trong oxi thu được 3,0 gam hỗn hợp chất rắn X. Hòa tan hết hỗn hợp X trong dung dịch HNO3 (dư), thoát ra 0,56 lít khí NO (là sản phẩm khử duy nhất, đo ở đktc). Giá trị của m là
A. 2,90. B. 2,52. C. 2,10. D. 4,20.
B.55.
Hòa tan hoàn toàn 13,92 gam Fe3O4 bằng dung dịch HNO3 thu được 4,48ml khí NxOy (đktc). Khí NxOy là
A. N2O. B. NO2. C. N2O5. D. NO.
B.56.
Hỗn hợp X nặng 9 gam gồm Fe3O4 và Cu. Cho X vào dung dịch HCl dư thấy còn 1,6 gam Cu không tan. Khối lượng Fe3O4 có trong X là
A. 5,8 gam. B. 7,4 gam. C. 3,48 gam. D. 2,32 gam.
B.57.
Nung nóng hoàn toàn 27,3 gam hỗn hợp NaNO3, Cu(NO3)2. Hỗn hợp khí thoát ra được dẫn vào nước dư thì thấy có 1,12 lít khí (đktc) không bị hấp thụ ( lượng O2 hòa tan không đáng kể). Khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
A. 18,8 gam. B. 28,2 gam. C. 8,6 gam. D. 4,4 gam.
B.58.
Cho 11,6 gam muối FeCO3 tác dụng vừa đủ với dung dịch HNO3, được hỗn hợp khí CO2, NO và dung dịch X. Khi thêm dung dịch HCl (dư) vào dung dịch X, thì dung dịch thu được hoà tan tối đa bao nhiêu gam bột đồng kim loại, biết rằng có khí NO bay ra. .
A. 14,4 gam B. 7,2 gam. C. 16 gam. D. 32 gam.
B.59.
Hoà tan hỗn hợp X gồm Cu và Fe2O3 trong 400 ml dung dịch HCl a mol/lít được dung dịch Y và còn lại 1 gam đồng không tan. Nhúng thanh Mg vào dung dịch Y, sau khi phản ứng xong, nhấc thanh Mg ra thấy khối lượng tăng 4 gam so với ban đầu và có 1,12 lít khí H2 (đktc) bay ra.(Giả thiết toàn bộ lượng kim loại thoát ra đều bám vào thanh Mg). Khối lượng của Cu trong X và giá trị của a là
A. 1,0g và a = 1M B. 4,2g và a = 1M. C. 3,2g và 2M. D. 4,8g và 2M.
B.60.
Hoà tan hoàn toàn 5,94g Al vào dung dịch NaOH dư thu được khí X. Cho 1,896g KMnO4 tác dụng hết với axit HCl được khí Y. Nhiệt phân hoàn toàn 12,25g KClO3 có xúc tác thu được khí Z. Cho toàn bộ 3 khí Z, Y, Z trên vào bình kín rồi đốt cháy để phản ứng xảy ra hoàn toàn, sau đó đưa bình về nhiệt độ thường, thu được dung dịch T. Nồng độ phần trăm chất tan trong T là
A. 18,85% B. 28,85% C. 24,24% D. 31,65%
B.61.
Cho 200 ml dung dịch X chứa các ion NH4+ , K+ , SO42- , Cl- với nồng độ tương ứng là 0,5M , 0,1M , 0,25M , 0,1M. Biết rằng dung dịch X được điều chế bằng cách hoà tan 2 muối vào nướC. Khối lượng của 2 muối được lấy là
A. 6,6g (NH4)2SO4 và 7,45g KCl. B. 6,6g (NH4)2SO4 và 1,49g KCl.
C. 8,7g K2SO4 và 5,35g NH4Cl. D. 3,48g K2SO4 và 1,07g NH4Cl.
B.62.
Nung 44 gam hỗn hợp X gồm Cu và Cu(NO3)2 trong bình kín cho đến khi các phản ứng xảy ra hoàn toàn thu được chất rắn Y. Chất rắn Y phản ứng vừa đủ với 600 ml dung dịch H2SO4 0,5 M (Y tan hết). Khối lượng Cu và Cu(NO3)2 có trong hỗn hợp X là :
A. 6,4 g Cu; 37,6 g Cu(NO3)2 B. 9,6 g Cu; 34,4 g Cu(NO3)2
C. 8,8 g Cu; 35,2 g Cu(NO3)2 D. 12,4 g Cu; 31,6 g Cu(NO3)2
B.63.
Cho 7 gam hỗn hợp Cu, Fe (trong đó Fe chiếm 40% khối lượng) tác dụng với dd HNO3 loãng. Sau khi phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất), còn lại 4,6 gam kim loại không tan và dd X. Muối có trong dung dịch X là
A. Fe(NO3)3. B. Cu(NO3)2. C. Fe(NO3)3 và Cu(NO3)2. D. Fe(NO3)2.
B.64.
Hoà tan 36 gam hỗn hợp đồng và oxit sắt từ (ở dạng bột) theo tỉ lệ mol 2 : 1 bằng dung dịch HCl dư. Phản ứng xong thu được dung dịch X và chất rắn Y. Khối lượng chất rắn Y bằng
A. 12,8 gam. B. 6,4 gam. C. 23,2 gam. D. 16,0 gam.
B.65.
Hỗn hợp X gồm FeO, Fe2O3, Fe3O4 nặng 6,96 g và số mol FeO bằng số mol Fe2O3. Cho hỗn hợp X tan hết trong dung dịch HNO3 loãng, thu được V lít khí NO (đktc) duy nhất. Giá trị của V là
A. 0,224/3 lít. B. 0,224 lít. C. 2,24 lít. D. 2,24/3 lít.
B.66.
Cho 5,7 gam hỗn hợp bột P gồm Mg, Al, Zn, Cu tác dụng hoàn toàn với oxi dư thu được hỗn hợp rắn Q có khối lượng là 7,86 gam. Thể tích tối thiểu dung dịch HCl 1M cần dùng để hoà tan hoàn toàn Q là
A. 180 ml. B. 270 ml. C. 300 ml. D. 360 ml.
B.67.
Cho một lượng bột CaCO3 tác dụng hoàn toàn với dung dịch HCl 32,85%. Sau phản ứng thu được dung dịch X trong đó nồng độ HCl còn lại là 24,20%. Thêm vào X một lượng bột MgCO3 khuấy đều cho phản ứng xảy ra hoàn toàn thu được dung dịch Y trong đó nồng độ HCl còn là 21,10%. Nồng độ phần trăm các muối CaCl2 và MgCl2 trong dung dịch Y tương ứng là
A. 10,35% và 3,54%. B. 12,35% và 8,54%. C. 12,35% và 3,54%. D. 8,54% và 10,35%.
B.68.
Cho biết nguyên tử Zn có bán kính nguyên tử và khối lượng mol nguyên tử lần lượt là 0,138 nm và 65 gam/mol. Biết thể tích của Zn chỉ chiếm 72,5 % thể tích tinh thể. Tính khối lượng riêng của tinh thể Zn (Số Avogađro N= 6,023.1023).
A. 7,11 g/cm3 B. 9,81 g/ cm3 C. 5,15 g/ cm3 D. 7,79 g/cm3
B.69.
Cho a mol Fe tác dụng với dung dịch HNO3 thu được 2,24 L khí NO (sản phẩm khử duy nhất) ở điều kiện chuẩn và dung dịch X, còn dư 5,6 gam Fe. Cô cạn dung dịch X, thu được b gam muối khan. Tính a và b.
A. a = 0,25 mol, b = 27,0 gam. B. a = 0,20 mol, b = 24,2 gam.
C. a = 0,25 mol, b = 36,3 gam. D. a = 0,20 mol, b = 27,0 gam.
B.70.
Cho hỗn hợp có a mol Zn tác dụng với dung dịch chứa b mol Cu(NO3)2 và c mol AgNO3. Kết thúc phản ứng thu được dung dịch X và chất rắn Y. Biết a = b + 0,5C. Ta có :
A. dung dịch X chứa 1 muối và Y có 2 kim loại. B. dung dịch X chứa 2 muối và Y có 1 kim loại.
C. dung dịch X chứa 3 muối và Y chứa 2 kim loại. D. dung dịch X chứa 2 muối và Y chứa 2 kim loại.
B.71.
Cho hỗn hợp FeS và Fe tác dụng với dung dịch HCl (dư) thu được 2,8 lít hỗn hợp khí ở đktc. Dẫn hỗn hợp khí này đi qua dung dịch Pb(NO3)2 (dư), sinh ra 0,1 mol kết tủa màu đen. Thành phần % về khối lượng của Fe trong hỗn hợp ban đầu là :
A. 13,73% B. 21,56% C. 38,89% D. 54,9%
B.72.
Cho 11,2 gam Fe tác dụng vừa đủ với dung dịch H2SO4 loãng thu được dung dịch X. Cô cạn dung dịch X thấy thu được 55,6 gam chất rắn Y. Công thức chất rắn Y là :
A. Fe2(SO4)3. B. FeSO4. C. FeSO4.5H2O. D. FeSO4.7H2O.
B.73.
Thêm KOH vào dung dịch hỗn hợp chứa 0,01 mol H2SO4 và 0,01 mol Al2(SO4)3. Kết tủa thu được là lớn nhất và nhỏ nhất ứng với số mol KOH lần lượt bằng :
A. 0,02 mol và ³ 0,04 mol. B. 0,02 mol và ³ 0,05 mol.
C. 0,03 mol và ³ 0,08 mol. D. 0,08 mol và ³ 0,10 mol.
B.74.
Để điều chế thuốc diệt nấm là dung dịch CuSO4 5%, người ta thực hiện sơ đồ điều chế sau : CuS ® CuO ® CuSO4. Nếu hiệu suất quá trình điều chế là 80% thì khối lượng dung dịch CuSO4 thu được từ 1 kg nguyên liệu có chứa 80% CuS là :
A. 21,33 kg. B. 0,0532 kg. C. 33,25 kg. D. 7,68 kg.
B.75.
Trộn 6 g Mg bột với 4,5 g SiO2 rồi đun nóng ở nhiệt độ cao cho đến khi phản ứng xảy ra hoàn toàn. Lấy hỗn hợp thu được cho tác dụng với dung dịch NaOH dư. Thể tích khí hiđro bay ra ở điều kiện tiêu chuẩn là :
A. 1,12 lít B. 5,60 lít C. 0,56 lít D. 3,92 lít
B.76.
Cho 1,44g Mg tan vừa đủ trong 160ml dung dịch HNO3 1M thì thu được dung dịch có một muối và một khí X(ĐKTC). Khí X là :
A. NO2 B. NO C. N2 D. N2O
B.77.
Cho 16,2g kim loại M hoá trị 3 tan hết trong dung dịch HNO3 đủ được 5,6 lít hỗn hợp khí NO, N2 ở đktc và dung dịch có một muối. Tỉ khối của hỗn hợp khí so với Oxi là 0,9. Kim loại M là :
A. Cr B. Al C. Fe D. không xác định
B.78.
Hỗn hợp X có 0,01 mol ZnO và 0,14 mol Zn. Cho X vào dung dịch HNO3 dư thì thoát ra 0,448 lít khí Y ở đktc. Cô cạn dung dịch sau phản ứng thì thu được 29,15g muối khan. Khí Y là :
A. NO2 B. N2 C. NO D. N2O
B.79.
Hấp thụ hết 0,6384 lít khí SO2 ở đktc vào một lượng vừa đủ dung dịch KMnO4 thu được 2,28 lít dung dịch X không màu trong suốt . Giá trị pH của dung dịch X là :
A. 1 B. 2 C. 1,7 D. 2,3
B.80.
Để hoà tan hết 1,5 mol Cu bằng dung dịch : NaNO3 + H2SO4 loãng. Số mol NaNO3 tối thiểu cần có trong ddịch là :
A. 1 mol B. 3 mol C. 2 mol D. 4,5 mol
B.81.
Thể tích dung dịch Ba(OH)2 0,025M cần cho vào 100 ml dung dịch HCl có pH = 1 để thu được ddịch có pH = 2 là :
A. 150 ml B. 20 ml C. 200 ml D. 15 ml
B.82.
Đốt cháy 15,5 gam photpho rồi hoà tan sản phẩm cháy vào 200 gam nước thu được dung dịch X. Nồng độ % của chất tan trong dung dịch X là :
A. 19,68% B. 16,89% C. 18,69% D. 18,96%
B.83.
Cho dung dịch NaOH 20% tác dụng vừa đủ với dung dịch MgCl2 10% . Lọc bỏ kết tủa dung dịch thu được có nồng độ là :
A. 8,67% B. 6,09% C. 9,06% D. 7,68%
B.84.
Cho 200 ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M, lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là :
A. 1,8 B. 0,2 C. 2,4 D. 2
B.85.
Cho m gam hỗn hợp Mg, Al vào 250 ml dung dịch X chứa hỗn hợp axit HCl 1M và axit H2SO4 0,5M, thu được 5,32 lít H2 (ở đktc) và dung dịch Y (coi thể tích dung dịch không đổi). Dung dịch Y có pH là :
A. 7 B. 1 C. 2 D. 2,5
B.86.
Nung 6,58 gam Cu(NO3)2 trong bình kín, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hết X vào nước được 300 ml dung dịch Y. Dung dịch Y có pH bằng :
A. 1 B. 2 C. 3 D. 4
B.87.
Hoà tan hết m gam FeS2 trong dung dịch HNO3 vừa đủ thu được khí NO2 và dung dịch X chứa Fe3+ , SO42-, H+. Cho dung dịch X tác dụng với dung dịch BaCl2 dư thu được 18,64 gam kết tủa trắng. Lấy 1/10 dung dịch X hoà tan vào nước được 4 lít dung dịch Y. Giá trị pH của dung dịch Y là :
A. 2 B. 3 C. 3,39 D. 2,39
B.88.
Để m gam Fe trong không khí sau một thời gian thu được 12 gam hỗn hợp X gồm Fe, FeO, Fe2O3, Fe3O4. Cho X tác dụng với dung dịch HNO3 dư thu được 2,24 lít khí NO duy nhất ở đktc. Giá trị của m là :
A. 10,08 gam B. 9,8 gam C. 9,08 gam D. 10,8 gam
B.89.
Hoà tan hết 13,9 gam hỗn hợp gồm Mg - Al - Cu bằng 360 ml dung dịch HNO3 5M vừa đủ thu được 20,16 lít khí NO2 duy nhất ở đktc và dung dịch X. Cô cạn X khối lượng muối khan thu được là :
A. 76,9 gam B. 79,6 gam C. 69,7 gam D. 67,9 gam
B.90.
Cho dung dịch NH3 0,1M có K = 1,8.10-5 và dung dịch CH3COOH 0,1M có K = 1,8.10-5 . Nếu pH của hai dung dịch tương ứng là x và y thì :
A. x = y B. x = 2y C. x > y D. x < y
B.91.
Hoà tan hết hỗn hợp gồm 0,1 mol FeO , 0,1 mol Fe3O4 và 0,1 mol Fe2O3 vào dung dịch HNO3 thu được khí NO duy nhất và dung dịch X. Cô cạn dung dịch X thu được lượng muối khan là :
A. 125,4 gam B. 145,2 gam C. 154,2 gam D. 152,4 gam
B.92.
Sự tương tác giữa hiđro và iot có đặc tính thuận nghịch: H2 + I2 Û 2HI
Sau một thời gian phản ứng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch: vt = vn hay kt .[H2].[I2] = kn .[HI]2
Sau khi biến đổi chúng ta xây dựng được biểu thức hằng số cân bằng của hệ (Kcb).
Hỏi, nếu nồng độ ban đầu của H2 và I2 là 0,02mol/l, nồng độ cân bằng của HI là 0,03mol/l thì nồng độ cân bằng của H2 và hằng số cân bằng là bao nhiêu?
A. 0,005 mol và 18. B. 0,005 mol và 36. C. 0,05 mol và 18. D. 0,05 mol và 36.
B.93.
Cho phương trình hoá học: 2N2(k) + 3H2(k) ![]() 2NH3(k)
2NH3(k)
Nếu ở trạng thái cân bằng nồng độ của NH3 là 0,30mol/l, của N2 là 0,05mol/l và của H2 là 0,10mol/l. Hằng số cân bằng của hệ là giá trị nào sau đây?
A. 36. B. 360. C. 3600. D. 36000.
B.94.
Cho phương trình hoá học: CO(k) + Cl2(k) ![]() COCl2(k)
COCl2(k)
Biết rằng nồng độ cân bằng của CO là 0,20mol/l và của Cl2 là 0,30mol/l và hằng số cân bằng là 4. Nồng độ cân bằng của chất tạo thành ở một nhiệt độ nào đó cuả phản ứng là giá trị nào sau đây?
A. 0,24 mol/l B. 0,024 mol/l C. 2,4 mol/l D. 0,0024 mol/l
B.95.
Hòa tan hoàn toàn 28,8g kim loại Cu vào dd HNO3 loãng, tất cả khí NO thu được đem oxi hóa thành NO2 rồi sục vào nước có dòng oxi để chuyển hết thành HNO3. Thể tích khí oxi ở đktc đã tham gia vào quá trình trên là:
A. 100,8 lít B. 10,08lít C. 50,4 lít D. 5,04 lít
B.96.
Khi lấy 14,25g muối clorua của một kim loại M chỉ có hoá trị II và một lượng muối nitrat của M với số mol như nhau, thì thấy khối lượng khác nhau là 7,95g. Công thức của 2 muối là:
A. CuCl2, Cu(NO3)2 B. FeCl2, Fe(NO3)2 C. MgCl2, Mg(NO3)2 D. CaCl2, Ca(NO3)2
B.97.
Hoà tan hoàn toàn hỗn hợp gồm 0,05 mol Ag và 0,03 mol Cu vào dd HNO3 thu được hỗn hợp khí A gồm NO và NO2 có tỉ lệ số mol tương ứng là 2 : 3. Thể tích hỗn hợp A ở đktc là:
A. 1,368 lít. B. 2,737 lít. C. 2,224 lít. D. 3,3737 lít.
B.98.
Trộn 0,54 g bột nhôm với bột Fe2O3 và CuO rồi tiến hành phản ứng nhiệt nhôm thu được hỗn hợp A. Hoà tan hoàn toàn A trong dd HNO3 được hỗn hợp khí gồm NO và NO2 có tỉ lệ số mol tương ứng là 1 : 3. Thể tích (đktc) khí NO và NO2 lần lượt là (lít):
A. 0,224 và 0,672. B. 0,672 và 0,224. C. 2,24 và 6,72. D. 6,72 và 2,24.
B.99.
Cho hỗn hợp gồm FeO, CuO, Fe3O4 có số mol ba chất đều bằng nhau tác dụng hết với dd HNO3 thu được hỗn hợp khí gồm 0,09 mol NO2 và 0,05 mol NO. Số mol của mỗi chất là:
A. 0,12 B. 0,24 C. 0,21 D. 0,36
B.100.
Điện phân dd chứa 0,2 mol FeSO4 và 0,06mol HCl với dòng điện 1,34 A trong 2 giờ (điện cực trơ, có màng ngăn). Bỏ qua sự hoà tan của clo trong nước và coi hiệu suất điện phân là 100%. Khối lượng kim loại thoát ra ở katot và thể tích khí thoát ra ở anot (đktc) lần lượt là:
A. 1,12 g Fe và 0,896 lit hỗn hợp khí Cl2 , O2. B. 1,12 g Fe và 1,12 lit hỗn hợp khí Cl2 và O2.
C. 11,2 g Fe và 1,12 lit hỗn hợp khí Cl2 và O2 D. 1,12 g Fe và 8,96 lit hỗn hợp khí Cl2 và O2
B.101.
Trong một bình kín dung tích 5,6 lít có chứa một hỗn hợp khí gồm: NO2, N2, NO ở 00 C và 2atm. Cho vào bình 600 ml nước và lắc cho phản ứng xảy ra hoàn toàn thì thu được một hỗn hợp khí mới có áp suất là 1,344 atm ở nhiệt độ ban đầu . Hỗn hợp khí sau phản ứng có tỉ khối so với không khí bằng 1. Giả sử rằng thể tích nước không thay đổi trong thí nghiệm thì thành phần % theo thể tích của mỗi khí trong hỗn hợp đầu là :
A. 60% N2 ; 30% NO2 ; 10% NO B. 60% NO ; 30% NO2 ; 10% N2
C. 60% NO2 ; 30% N2 ; 10% NO D. 60% N2 ; 30% NO ; 10% NO2
B.102.
Điện phân dd hỗn hợp 0,1 mol Cu(NO3)2 và 0,06 mol HCl với dòng điện một chiều có cường độ 1,34 A trong 2 giờ, các điện cực trơ. Khối lượng kim loại thoát ra ở katot (gam) và thể tích khí ở đktc thoát ra ở anot (lit) bỏ qua sự hoà tan của clo trong nước và coi hiệu suất điện phân là 100% nhận những giá trị nào sau đây:
A. 3,2 gam và 0,896 lit. B. 0,32 gam và 0,896 lit. C. 6,4 gam và 8,96 lit. D. 6,4 gam và 0,896 lit
B.103.
Một dd chứa 0,1mol Na+, 0,1 mol Ca2+, 0,1mol Cl- và 0,2 mol HCO3-. Cô cạn dd ở áp suất thấp, nhiệt độ thấp thì thu được m gam hỗn hợp muối khan. Nếu cô cạn dd ở áp suất khí quyển, nhiệt độ cao thì thu được n gam hỗn hợp muối khan. So sánh m và n ta có:
A. m = n. B. m < n. C. m > n. D. Không xác định.
B.104.
Pin điện hóa Zn-Cu trong quá trình phóng điện xảy ra phản ứng: Zn(r) + Cu2+(dd) ® Zn2+(dd) + Cu(r)
Eo(Zn2+.Zn) = - 0,76(V); Eo(Cu2+.Cu) = +0,34(V)
Suất điện động chuẩn của pin điện hóa là:
A. 0,40V B. -0,42V C. 1,25V D. 1,10V
B.105.
Cho 1,58 gam hỗn hợp A ở dạng bột gồm Mg và Fe tác dụng với 125ml dd CuCl2. Khuấy đều hỗn hợp, lọc rửa kết tủa thu được dd B và 1,92 gam chất rắn C.Thêm vào B một lượng dư dd NaOH loãng, lọc rửa kết tủa mới tạo thành. Nung kết tủa trong không khí ở nhiệt độ cao thu được 0,7 gam chất rắn D gồm hai oxit kim loại. Số phản ứng hoá học đã xảy ra trong thí nghiệm trên là:
A. 4. B. 5. C. 6. D. 7.
B.106.
Hai thanh kim loại R hoá trị II có khối lượng a gam , Thanh thứ nhất nhúng vào 100 ml dung dịch AgNO3 ,thanh thứ 2 nhúng vào 1,51 lít dung dịch Cu(NO3)2 . Sau 1 thời gian lấy 2 thanh kim loại ra thì thấy thanh thứ nhất tăng khối lượng , thanh thứ 2 giảm khối lượng nhưng khối lượng 2 thanh vẫn là 2a gam , đồng thời nồng độ mol của muối kim loại R trong dung dịch Cu(NO3)2 gấp 10 lần trong dung dịch AgNO3. Vậy kim loại R hoá trị II là:
A. Mg B. Fe C. Ni D. Zn
LÝ THUYẾT HỮU CƠ
C.1.
Đốt cháy hoàn toàn m gam một rượu no X thu được cũng m gam H2O. Biết khối lượng phân tử của X nhỏ hơn 100 đvC. Số đồng phân cấu tạo của rượu X là
A. 4 B. 6 C. 5 D. 3
C.2.
Cho các sơ đồ phản ứng sau :
a) 6X ![]() Y b) X + O2
Y b) X + O2 ![]() Z c) E + H2O
Z c) E + H2O ![]() G
G
Điều khẳng định nào sau đây đúng
A. Các chất X, Y, Z, E, F, G đều có cùng số C trong phân tử.
B. Chỉ có X và E là hiđrocacbon
C. Các chất X, Y, Z, E, F, G đều phản ứng được với dung dịch Ag2O trong NH3.
D. Các chất X, Y, Z, E, F, G đều có nhóm chức –CHO trong phân tử.
C.3.
Số đồng phân mạch hở có công thức phân tử C4H9NO2 khi phản ứng với dung dịch NaOH ở điều kiện thường tạo ra amoniac là
A. 2 B. 3 C. 4 D. 5
C.4.
Cho H2SO4 đặc vào saccarozơ ở điều kiện thường thu được một chất khí bay ra có khả năng làm mất màu dung dịch thuốc tím . Chất đó là :
A. Hơi H2SO4 B. Khí CO2 C. Khí SO2 D. Khí H2S.
C.5.
Hỗn hợp gồm C2H5OH, CH3CHO, CH3COOH. Người ta thu hồi CH3COOH bằng cách dùng hoá chất
A. Na, dung dịch H2SO4 B. Ag2O/NH3, dung dịch H2SO4
C. Cu(OH)2, dung dịch NaOH D. dung dịch NaOH, dung dịch H2SO4
C.6.
Cho sơ đồ: Rượu ¾® anken ¾® polime. Có bao nhiêu polime tạo thành từ rượu có công thức phân tử C5H12O có mạch cacbon phân nhánh:
A. 3 B. 4 C. 5 D. 6
C.7.
Cho sơ đồ sau: X + H2 → Y ; X + O2 → Z ; Y + Z → C4H4O4 + 2H2O. Các chất Y, Z là
A. Y : CH3OH ; Z : C2H2O4 B. Y : C2H4(OH)2 ; Z : H2CO2
C. Y : C2H5OH ; Z : C2H2O4 D. Y : C2H4(OH)2 ; Z : C2H2O4
C.8.
Chất X (C8H14O4) thoả mãn sơ đồ các phản ứng sau:
a) C8H14O4 + 2NaOH → X1 + X2 + H2O b) X1 + H2SO4 → X3 + Na2SO4
c) nX3 + nX4 → Nilon-6,6 + nH2O d) 2X2 + X3 → X5 + 2H2O
Công thức cấu tạo của X (C8H14O4) là
A. HCOO(CH2)6 OOCH B. CH3OOC(CH2)4COOCH3
C. CH3OOC(CH2)5COOH D. CH3CH2OOC(CH2)4COOH
C.9.
Cho các chất sau: C2H5O-H (1), CH3CO(O-H) (2), HCO(O-H) (3), C6H5O-H (4), R-C=CH-H (5), R-C≡C-H (6). Chiều tăng dần độ linh động của các nguyên tử H trong các nhóm chức của các chất trên là:
A. 1 < 4 < 3 < 2 < 5 < 6 B. 5 < 6 < 1 < 4 < 2 < 3 C. 4 < 1 < 3 < 2 < 6 < 5 D. 6 < 5 < 4< 1< 2 < 3
C.10.
Để tách loại các chất khí: propin, etylen, metan ra khỏi hỗn hợp của chúng, có thể dùng những hóa chất thuộc nhóm nào sau đây: (các phương tiện khác coi như có đủ)
A. dd Br2, dd KOH/ rượu và dd KMnO4 B. dd Br2, Zn và dd Ag2O/NH3.
C. dd HNO3 đặc và dd KOH D. dd HCl, dd KOH/Rượu và dd Ag2O/NH3
C.11.
Dãy axit nào trong các axit sau đây làm mất màu dung dịch brom?
axit fomic, axit axetic, axit acrylic, axit propinoic, axit benzoic
A. axit benzoic, axit acrylic, axit propinoic. B. axit acrylic, axit axetic, axit propinoic.
C. axit fomic, axit acrylic, axit propinoic. D. axit acrylic, axit propinoic.
C.12.
Cho 2 phản ứng:
(1) 2CH3COOH + Na2CO3 ¾® 2CH3COONa + H2O + CO2
(2) C6H5ONa + CO2 + H2O ¾® C6H5OH + NaHCO3
Hai phản ứng trên chứng tỏ lực axit theo thứ tự CH3COOH, H2CO3, C6H5OH, HCO3- là
A. tăng dần. B. giảm dần. C. không thay đổi. D. vừa tăng vừa giảm.
C.13.
Sắp xếp các chất sau theo thứ tự lực axit giảm dần: etanol (X), phenol (Y), axit benzoic (Z), p-nitrobenzoic (T), axit axetic (P)
A. X > Y > Z > T > P. B. X > Y > P > Z > T. C. T > Z > P > Y > X. D. T > P > Z > Y> X.
C.14.
Hợp chất A1 có CTPT C3H6O2 thoả mãn sơ đồ:
Cấu tạo thoả mãn của A1 là
A. HO-CH2-CH2-CHO. B. CH3-CH2-COOH. C. HCOO-CH2-CH3. D. CH3-CO-CH2-OH.
C.15.
Cho sơ đồ: Rượu ¾® anken ¾® polime. Có bao nhiêu polime tạo thành từ rượu có công thức phân tử C5H12O có mạch cacbon phân nhánh:
A. 3. B. 4. C. 5. D. 6.
C.16.
Cho các sơ đồ phản ứng sau :
a) 6X ![]() Y b) X + O2
Y b) X + O2 ![]() Z c) E + H2O
Z c) E + H2O ![]() G
G
Điều khẳng định nào sau đây đúng
A. Các chất X, Y, Z, E, F, G đều có cùng số C trong phân tử.
B. Chỉ có X và E là hiđrocacbon
C. Các chất X, Y, Z, E, F, G đều phản ứng được với dung dịch Ag2O trong NH3.
D. Các chất X, Y, Z, E, F, G đều có nhóm chức –CHO trong phân tử.
C.17.
Y là một polime rất cứng, không giòn và trong suốt, Y được sử dụng để chế tạo lăng kính, thấu kính, vật liệu cho kĩ thuật laze, làm răng giả. Người ta gọi Y là thủy tinh hữu cơ. Y được điều chế từ phản ứng trùng hợp monome X là :
A. CH2=CH–COO–CH3 B. CH2=CH–COO–CH2–CH3
C. CH2=C(CH3)–COOCH3 D. CH3–COOCH=CH2
C.18.
Cho ancol isoamylic tác dụng với axit axetic để điều chế dầu chuối, người ta thu được một hỗn hợp gồm dầu chuối, axit dư và ancol dư. Để tách dầu chuối ra khỏi hỗn hợp trên, người ta cho vào hỗn hợp một dung dịch X vừa đủ, khi đó axit tan vào lớp nước. Hỗn hợp ancol và dầu chuối hòa tan trong nhau tách thành lớp riêng. Chưng cất hỗn hợp này để tách dầu chuối ra khỏi ancol. Dung dịch X được dùng trong thí nghiệm này là :
A. dung dịch NaOH. B. nước vôi trong. C. dung dịch Na2CO3 D. benzen.
C.19.
Phản ứng nào trong các phản ứng sau KHÔNG tạo xeton ?
A. CH3–CH(OH)–CH3 + CuO B. CH3–CCl2–CH3 + NaOH dư
C. CH3–COO–C(CH3)=CH2 + NaOH dư D. CH3–COOCHCl–CH3
C.20.
Cho 3 hoặc 4 giọt chất lỏng X tinh khiết vào một ống nghiệm có sẵn 1-2 mL nước, lắc đều thu được một chất lỏng trắng đục, để yên một thời gian thấy xuất hiện 2 lớp chất lỏng phân cách. Cho 1 mL dung dịch HCl vào và lắc mạnh lại thu được một dung dịch đồng nhất. Cho tiếp vào đó vài giọt dung dịch NaOH thấy xuất hiện lại hai lớp chất lỏng phân cách. X là chất nào trong số các chất sau :
A. hồ tinh bột. B. anilin. C. phenol lỏng. D. lòng trắng trứng.
C.21.
Khi thủy phân một peptit, chỉ thu được các đipeptit Glu-His ; Asp-Glu ; Phe-Val và Val-Asp.
Cấu tạo của peptit đem thủy phân là :
A. Phe-Val-Asp-Glu-His. B. His-Asp-Glu-Phe-Val-Asp-Glu.
C. Asp-Glu-Phe-Val-Asp-Phe-Val-Asp. D. Glu-Phe-Val-Asp-Glu-His-Asp-Val-Asp.
C.22.
Khi đun nóng nhựa rezol (poliphenolfomanđehit mạch thẳng) là một chất nhựa dẻo tới 150oC thì thấy nó biến thành chất rắn giòn. Đó là do :
A. đã xảy ra phản ứng ngưng tụ các cầu nối –CH2– nối các chuỗi polime thành mạng không gian.
B. đã xảy ra phản ứng phân cắt nhựa này thành các polime có mạch ngắn hơn.
C. đã xảy ra phản ứng thủy phân nhựa này để tạo lại phenol ở trạng thái rắn.
D. đã xảy ra phản ứng lão hóa polime dưới tác dụng của nhiệt, oxi không khí và ánh sáng.
C.23.
Cho chuyển hóa :
X, Y trong chuyển hóa trên lần lượt là :
A. HCHO, CH2OH-CHO. B. CH3OH, HCHO. C. CH3OH, HCOOH. D. HCHO, HCOOH.
C.24.
pKa là một trong các đại lượng dùng để đánh giá độ mạnh của các axit. pKa càng nhỏ chứng tỏ độ mạnh của axit đó càng lớn. Các giá trị 1,24; 4,18; 4,25; 1,84 là pKa của 4 axit C6H5COOH, CH2=CH–COOH, CHºC–COOH, CHF2–COOH nhưng chưa được xếp theo đúng thứ tự. Giá trị pKa gần đúng cho axit CHF2–COOH là:
A. 4,18. B. 4,25. C. 1,84. D. 1,24.
C.25.
Phản ứng nào sau đây tạo CH3–CO–CH3 ?
A. CH3–CH2–CH2OH + O2 (xúc tác Cu, tOC) B. CH3-CHCl–CH2Cl + NaOH (tOC)
C. (CH3COO)2Ca (tOC) D. CH3-CHOH-CH3 (H2SO4 đậm đặc, tO > 170OC)
C.26.
Kết quả so sánh độ mạnh tính axit của cặp chất nào sau đây là đúng ?
A. CH3–COOH > HCOOH B. CH3–COOH < CH3–CH2–COOH.
C. CH3–COOH > CH2=CH–COOH. D. CH3–COOH < CH2Cl–COOH.
C.27.
Để nhận biết một lọ mất nhãn đựng một chất lỏng X, người ta tiến hành một số thí nghiệm với kết quả sau : X không làm hồng giấy quỳ tím, không làm hồng thuốc thử Ship, không tác dụng với Cu(OH)2. Khi loại hết nước của dung dịch, X sủi bọt khí khi tiếp xúc với Na. Sau khi phản ứng với I2/NaOH cho kết tủa vàng sáng. X có thể là :
A. CH3–CH2OH. B. CH3–CHO. C. CH3–COOH. D. CH2OH–CH2OH.
C.28.
Nếu chỉ xét sản phẩm chính thì phản ứng đúng là :
C.29.
Phản ứng nào sau đây đúng ?
A. ClNH3 – R – COOH + NaOH → ClNH3 – R – COONa + H2O
B. ClNH3 – R – COOH + 2NaOH → NH2 – R – COONa + H2O + NaCl
C. ClNH3 – R – COOH + NaOH → ClNH3 – R – COONa + H2O
D. 2NH2 – R – COONa + H2SO4 → 2NH2 – R – COOH + Na2SO4
C.30.
Phản ứng nào sau đây đúng?
C.31.
PTHH nào sau đây không đúng ?
A. CH2=CH–CH2–Cl + H2O![]() CH2=CH–CH2–OH + HCl
CH2=CH–CH2–OH + HCl
B. CH3–CH–CH2–Cl + H2O![]() CH3–CH–CH2–OH + HCl
CH3–CH–CH2–OH + HCl
C. C6H5–Cl + 2NaOH ![]() C6H5–ONa + NaCl + H2O
C6H5–ONa + NaCl + H2O
D. CH2=CH– Cl + NaOH ![]() CH3–CHO + NaCl
CH3–CHO + NaCl
C.32.
Dãy chuyển hóa nào sau đây không đúng ?
A. CH4®C2H2®C4H4®C4H6®Cao su buna
B. CH4®C2H2®CH3CHO®C2H5OH®C4H6®Cao su buna
C. CH4®C2H2®C2H3OH®C2H5OH®C4H6®Cao su buna
D. CH4®C2H2®C2H6®C2H5Cl®C2H5OH®C4H6®Cao su buna
C.33.
Nếu chỉ xét sản phẩm chính thì sơ đồ chuyển hóa nào sau đây KHÔNG đúng ?
A. CH3CHOHCH3![]() CH3CH=CH2
CH3CH=CH2![]() CH3CH2CH2OH
CH3CH2CH2OH
B. CH3CH2CH2OH![]() CH3CH=CH2
CH3CH=CH2![]() CH3CHOHCH3
CH3CHOHCH3
C. CH3CH2CH2OH![]() CH3CH=CH2
CH3CH=CH2![]() CH3CHClCH3
CH3CHClCH3![]() CH3CHOHCH3
CH3CHOHCH3
D. CH3CH2CH2OH![]() CH3CH2CH2Cl
CH3CH2CH2Cl![]() CH3CH2CHOH
CH3CH2CHOH
C.34.
Phản ứng polime hóa nào sau đây không đúng ?
A.
C.
C.35.
Chỉ xét sản phẩm chính thì dãy chuyển hóa nào sau đây đúng ?
A. C6H6 ® C6H5Cl ® C6H5ONa ® C6H5OH ® Ba(C6H5O)2
B. C6H6 ® C6H5Cl ® o-NO2C6H4Cl ® m-NO2C6H4OH
C. C6H6 ® C6H5NO2 ® m-NO2C6H4Cl ® m-NO2C6H4ONa
D. C6H6 ® C6H5NO2 ® o-NO2C6H4NO2 ® o-NH2C6H4NH2
C.36.
Phản ứng điều chế amin nào dưới đây không hợp lí ?
A. CH3I + NH3 ® CH3NH2 + HI B. 2C2H5I + NH3 ® (C2H5)2NH + 2HI
C. C6H5NO2 + 3H2 ® C6H5NH2 + 2H2O D. C6H5CN + 4H ![]() C6H5CH2NH2
C6H5CH2NH2
C.37.
Thủy phân peptit :
Sản phẩm nào dưới đây là không thể có ?
A. Ala B. Gli-Ala C. Ala-Glu D. Glu-Gli
C.38.
Dưới đây là một số mô tả quá trình chuyển hóa, từ cấu trúc không bền thành cấu trúc bền :
Quá trình nào không đúng ?
A. X B. Y C. Z D. T
C.39.
Trong dung dịch rượu (ancol) etylic có các kiểu liên kết H dưới đây :
Kiểu liên kết H bền nhất là :
A. X. B. Y. C. Z. D. T.
C.40.
Xitral (trong tinh dầu xả) có tên gọi hệ thống là 3,7-đimetylocta-2,6-đienal. Công thức cấu tạo của chất này là :
C.41.
Quá trình nào dưới đây được sử dụng để điều chế một thuốc nổ thông dụng ?
C.42.
Cấu tạo nào dưới đây phù hợp với dữ kiện về chất X, biết 1 mol X tác dụng vừa đủ với 1 mol brom hoặc 4 mol H2 và khi oxi hóa mãnh liệt X tạo ra axit o-phtalic o-C6H4(COOH)2.
C.43.
Phương trình hoá học nào dưới đây được viết đúng ?
C.44.
Phương trình hoá học biểu diễn phản ứng este hóa nào dưới đây được viết đúng ?
C.45.
Phân tử protit gồm
A. các mạch dài polipeptit hợp thành. B. các phân tử aminoaxit hợp thành.
C. các liên kết peptit hợp thành. D. các nhóm amino và cacbonyl hợp thành.
C.46.
Thuỷ phân hợp chất:
thu được các aminoaxit nào sau đây:
A. H2N-CH2-CH2-COOH B. HOOC-CH2-CH(NH2)-COOH
C. C6H5-CH(NH2)-COOH D. CH3-CH(NH2)-COOH
C.47.
Điều chế P.V.C từ than đá, đá vôi và các chất vô cơ khác phải viết ít nhất:
A. 4 phương trình B. 5 phương trình C. 6 phương trình D. 7 phương trình
C.48.
Điều chế P.V.A (polivinylaxetat) từ metan phải viết tối thiểu:
A. 3 phương trình B. 4 phương trình C. 5 phương trình D. 6 phương trình
BÀI TẬP HỮU CƠ
D.1.
Một hỗn hợp gồm 2 este đơn chức X, Y có khối lượng 32,6 gam. Chia hỗn hợp trên thành 2 phần đều nhau. Xà phòng hoá hoàn toàn phần 1 bằng một lượng vừa đủ 125 ml dung dịch NaOH 2M đun nóng, thu được 1 rượu và 2 muối.Cho phần 2 tác dụng với lượng dư dung dịch Ag2O trong NH3 thu được 43,2 gam Ag. Khối lượng và công thức của các este X, Y có trong hỗn hợp ban đầu lần lượt là:
A. 24 gam HCOOCH3 và 8,6 gam C2H3COOCH3 B. 24 gam HCOOCH3 và 8,6 gam C2H5COOCH3
C. 12 gam HCOOCH3 và 20,6 gam C2H3COOCH3 D. 12 gam HCOOCH3 và 20,6 gam CH3COOCH3
D.2.
Rượu no X là đồng đẳng của etylen glicol, có phần trăm khối lượng oxi bằng 35,55%. X hoà tan được Cu(OH)2 tạo dung dịch màu xanh lam. Số đồng phân cấu tạo thoả mãn tính chất trên của X là
A. 2 B. 3 C. 4 D. 5
D.3.
Người ta sản xuất xenlulozơ trinitrat từ xenlulozơ và axit nitric (sự hao hụt trong sản xuất là 12 %). Khối lượng xenlulozơ cần dùng để sản xuất ra 1 tấn xenlulozơ trinitrat là
A. 609,83 kg B. 619,83 kg C. 629,83 kg D. 639,83 kg
D.4.
Chất hữu cơ X (chứa C, H, N, O) có công thức phân tử trùng với công thức đơn giản nhất. Trong X, chứa 40,45% C, 7,86% H, 15,73% N, còn lại là oxi. Khi cho 4,45 gam X tác dụng với NaOH vừa đủ thu được 4,7 gam muối khan. Công thức cấu tạo của X là
A. H2N-CH2-CH2-COOH B. CH3-CH(NH2)-COOH
C. H2N-CH2-COO-CH3 D. CH2=CH-COO-NH4
D.5.
a-aminoaxit X chứa một nhóm –NH2. Cho 10,3 gam X tác dụng với axit HCl(dư), thu được 13,95 gam muối khan. Công thức cấu tạo thu gọn của X là
A. H2NCH2COOH B. H2NCH2CH2COOH
C. CH3CH2CH(NH2)COOH D. CH3CH(NH2)COOH
D.6.
Đốt cháy hoàn toàn 10 ml một este cần 45 ml O2 thu được V![]() : V
: V![]() = 4 : 3. Ngưng tụ sản phẩm cháy thấy thể tích giảm 30 ml. Các thể tích đo ở cùng điều kịên. Công thức của este đó là
= 4 : 3. Ngưng tụ sản phẩm cháy thấy thể tích giảm 30 ml. Các thể tích đo ở cùng điều kịên. Công thức của este đó là
A. C4H6O2 B. C4H6O4 C. C4H8O2 D. C8H6O4
D.7.
Cho hỗn hợp hai aminoaxit đều chứa 1 nhóm amino và 1 nhóm cacboxyl vào 440 ml dung dịch HCl 1M được dung dịch X. Để tác dụng hết với dung dịch X cần 840 ml dung dịch NaOH 1M. Vậy khi tạo thành dung dịch X thì
A. aminoaxit và HCl cùng hết B. dư aminoaxit
C. dư HCl D. không xác định được
D.8.
Đun 9,2 gam glixerin và 9 gam CH3COOH có xúc tác thu được m gam sản phẩm hữu cơ E chứa một loại nhóm chứC. Biết hiệu suất phản ứng bằng 60%. Giá trị của m là:
A. 8,76 B. 9,64 C. 7,54 D. 6,54
D.9.
Xà phòng hoá hoàn toàn 0,1 mol một este đơn chức bằng 180 ml dung dịch MOH 1 mol/lít (M là kim loại kiềm). Cô cạn dung dịch thu được chất rắn A. Đốt hết chất rắn A thu được 12,42 gam M2CO3. Kim loại M là
A. Li B. Na C. K D. Rb
D.10.
Cho 3,584 lít (đktc) hỗn hợp gồm một ankan (X), một anken (Y), một ankin (Z). Lấy ½ hỗn hợp cho tác dụng với dung dịch AgNO3 dư trong amoniac thấy thể tích hỗn hợp giảm 12,5% và thu được 1,47 gam kết tủA. Cho ½ hỗn hợp còn lại đi qua dung dịch brom dư thấy khối lượng bình brom tăng 2,22 gam và có 13,6 gam brom đã phản ứng. Đốt cháy hoàn toàn lượng khí đi ra khỏi bình brom rồi hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ba(OH)2 dư thì thu được 2,955 gam kết tủA. Các chất X, Y, Z lần lượt là:
A. CH4, C2H4, C2H2 B. C3H8, C2H4, C3H4 C. C3H8, C2H4, C2H2 D. CH4, C2H4, C3H4
D.11.
Hỗn hợp Z gồm 2 axit no đơn chức kế tiếp nhau trong dãy đồng đẳng. Đốt cháy hoàn toàn một lượng hỗn hợp Z thu được CO2 có khối lượng lớn hơn khối lượng H2O là 2,73 gam. Nếu lấy cùng một lượng hỗn hợp Z như trên cho tác dụng với NaOH vừa đủ thì sau phản ứng thu được lượng muối khan là 3,9 gam. Công thức 2 axit là:
A. HCOOH và CH3COOH B. CH3COOH và C2H5COOH
C. C2H5COOH và C3H7COOH D. C3H7COOH và C4H9COOH
D.12.
Đốt cháy hoàn toàn 1,8 gam rượu no Z thu được 1,8 gam nướC. Biết MZ < 100. Số công thức cấu tạo có thể có của Z là:
A. 3 B. 6 C. 5 D. 7
D.13.
Chất hữu cơ Y1 trong phân tử chỉ chứa một loại nhóm chức, có phần trăm khối lượng C và H tương ứng bằng 49,315% và 6,85%, còn lại là oxi. Tỉ khối hơi của Y1 so với không khí xấp xỉ bằng 5,034. Cho Y1 tác dụng với dung dịch NaOH, sinh ra một muối (Y2) và một rượu (Y3). Nung muối Y2 với hỗn hợp vôi tôi xút thu được một hiđrocacbon đơn giản nhất. Công thức Y2 và Y3 lần lượt là:
A. HCOONa và HOCH2CH2CH2CH2OH B. CH3CH2COONa và CH3CH2CH2OH
C. CH3COONa và HOCH2CH2OH D. NaOOCCH2COONa và CH3OH.
D.14.
Đốt cháy hoàn toàn 7,7 gam chất hữu cơ Z (có công thức phân tử trùng với công thức đơn giản nhất) bằng oxi, thu được 6,3 gam H2O, 4,48 lít CO2, 1,12 lít N2 (các khí đo ở đktc). Cho Z phản ứng với dung dịch NaOH đun nóng, được khí Z1. Khí Z1 làm xanh giấy quì tím ẩm và khi đốt cháy Z1 thu được sản phẩm làm đục nước vôi trong. Công thức cấu tạo của Z là công thức nào sau đây:
A. HCOOH3NCH3 B. CH3COONH4 C. CH3CH2COONH4 D. CH3COOH3NCH3
D.15.
Z là este tạo bởi rượu metylic và axit cacboxylic Y đơn chức, mạch hở, có mạch cacbon phân nhánh. Xà phòng hoá hoàn toàn 0,6 mol Z trong 300 ml dung dịch KOH 2,5M đun nóng, được dung dịch E. Cô cạn dung dịch E được chất rắn khan F. Đốt cháy hoàn toàn F bằng oxi dư, thu được 45,36 lít khí CO2 (đktc), 28,35 gam H2O và m gam K2CO3. Công thức cấu tạo của Y và giá trị của m là:
A. CH3CH(CH3)COOH ; m = 51,75g B. CH2=C(CH3)COOH ; m = 51,75g
C. CH3CH(CH3)COOH ; m = 41,40g D. CH2=C(CH3)COOH ; m = 41,40g
D.16.
Hỗn hợp X gồm metanal và etanal. Khi oxi hóa (H = 100%) m gam hỗn hợp X thu được hỗn hợp Y gồm hai axit hữu cơ tương ứng có d Y/X = x. Giá trị của x trong khoảng nào sau đây ?
A. 1 < x < 1,36 B. 1,36 < x < 1,53 C. 1,53 < x< 1,62 D. 1,62 < x < 1,75
D.17.
Đun nóng 0,1 mol X với lượng vừa đủ dung dịch NaOH thu được 13,4 gam muối của axit hữu cơ đa chức Y và 9,2 gam rượu đơn chức Z. Cho rượu Z bay hơi thì thu được thể tích là 4,48 lít (đktc). Công thức của X là:
A. CH(COOCH3)3 B. CH3CH2OOC-COOCH2CH3
C. C2H5OOC-CH2-COOC2H5 . D. C2H5OOC-CH2-CH2-COOC2H5
D.18.
Khi tách nước n phân tử rượu no đơn chức kế tiếp nhau, thu được hỗn hợp gồm x phân tử ete khác nhau. Biết tổng khối lượng mol phân tử của x ete là 612 g; khối lượng mol của từng rượu nhỏ hơn 102. Công thức của các rượu là:
A. CH3OH; C2H5OH B. C2H5OH; C3H7OH, C4H9OH
C. C3H7OH; C4H9OH D. C4H9OH; C5H11OH; C6H13OH
D.19.
Chất hữu cơ X có 1 nhóm amino, 1 chức este. Hàm lượng nitơ trong X là 15,73%. Xà phòng hóa m gam chât X, hơi rượu bay ra cho đi qua CuO nung nóng được andêhit Y. Cho Y thực hiện phản ứng tráng bạc thấy có 16,2 gam Ag kết tủA. Giá trị của m là:
A. 7,725 gam B. 3,3375 gam C. 6,675 gam D. 5,625 gam
D.20.
X là một a-aminoaxit no, mạch nhánh chỉ chứa một nhóm -NH2 và một nhóm -COOH. Cho 23,4 gam X tác dụng với dung dịch HCl dư thu được 30,7 gam muối. Công thức cấu tạo thu gọn của X là
A. CH3-CH2-CH2-CH(NH2)-COOH. B. H2N-CH2-COOH.
C. H2N-CH(CH3)-CH2-COOH. D. CH3-CH(CH3)-CH(NH2)-COOH.
D.21.
Cho 1 mol CH3COOH và 1 mol C2H5OH vào một bình phản ứng có axit sunfuric đặc làm xúc tác, sau khi phản ứng xảy hoàn toàn thu được m gam este. Giá trị của m là
A. 46 gam. B. 60 gam. C. 88 gam. D. 60 gam < m < 88 gam.
D.22.
X mạch hở có công thức C3Hy. Một bình có dung tích không đổi chứa hỗn hợp khí X và O2 dư ở 1500C, có áp suất 2atm. Bật tia lửa điện để đốt cháy X sau đó đưa bình về 1500C, áp suất bình vẫn là 2atm.Người ta trộn 9,6 gam X với hidro rồi cho qua bình đựng Ni nung nóng ( H = 100%) thì thu được hỗn hợp Y. Khối lượng mol trung bình của Y là
A. 48,5. B. 42,5. C. 46,5. D. 52,5.
D.23.
Cho X là một aminoaxit. Khi cho ,01 mol X tác dụng với HCl thì dùng hết 80ml dung dịch HCl 0,125M và thu được 1,835 gam muối khan. Khi cho 0,01 mol X tác dụng với dung dịch NaOH thì cần dùng 25 gam dung dịch NaOH 3,2%. Công thức cấu tạo của X là
A. NH2C3H5(COOH)2. B. (NH2)2C3H5COOH. C. NH2C3H6COOH. D. (NH2)2C5H9COOH.
D.24.
Oxi hóa m gam một hỗn hợp X gồm fomanđehit và axetanđehit bằng oxi ở điều kiện thích hợp thu được hỗn hợp Y chỉ gồm các axit hữu cơ. Tỉ khối hơi của Y so với X bằng x. Khoảng biến thiên của x là
A. 1,30 < x < 1,50. B. 1,36 < x < 1,53. C. 1,30 < x < 1,53. D. 1,36 < x < 1,50.
D.25.
Hỗn hợp X có 2 este đơn chức là đồng phân của nhau. Cho 5,7 gam hỗn hợp X tác dụng hết với 100ml dung dịch NaOH 0,5M thu được hỗn hợp Y có hai hai ancol bền, cùng số nguyên tử cacbon trong phân tử. Y kết hợp vừa hết với ít hơn 0,06 gam H2. Công thức hai este là
A. C2H3COOC3H7 và C3H7COOC2H5. B. C2H3COOC3H7 và C2H5COOC3H5.
C. C3H5COOC2H5 và C3H7COOC2H3. D. C3H5COOC3H7 và C3H7COOC3H5.
D.26.
TNT (2,4,6- trinitrotoluen) được điều chế bằng phản ứng của toluen với hỗn hợp gồm HNO3 đặc và H2SO4 đặc, trong điều kiện đun nóng. Biết hiệu suất của toàn bộ quá trình tổng hợp là 80%. Lượng TNT (2,4,6- trinitrotoluen) tạo thành từ 230 gam toluen là
A. 550,0 gam. B. 687,5 gam. C. 454,0 gam. D. 567,5 gam.
D.27.
Xà phòng hóa hoàn toàn 2,22 gam hỗn hợp X gồm hai este đồng phân của nhau cần dùng vừa hết 30ml dung dịch NaOH 1M. Mặt khác khi đốt cháy hoàn toàn hỗn hợp X thu được khí CO2 và hơi H2O với thể tích bằng nhau (ở cùng điều kiện). Công thức của hai este đó là
A. HCOOCH2CH2CH3 và HCOOCH(CH3)CH3. B. CH3COOCH3 và HCOOC2H5.
C. CH3COOC2H5 và C2H5COOCH3. D. CH3COOCH=CH2 và CH2=CHCOOCH3.
D.28.
Cho 100ml dung dịch aminoaxit X 0,2M tác dụng vừa đủ với 80ml dung dịch NaOH 0,25M. Mặt khác 100ml dung dịch aminoaxit trên tác dụng vừa đủ với 80ml dung dịch HCl 0,5M. Biết X có tỉ khối hơi so với H2 bằng 52. Công thức của X là
A. (H2N)2C2H2(COOH)2. B. H2NC3H5(COOH)2.
C. (H2N)2C2H3COOH. D. H2NC2H3(COOH)2
D.29.
Cho ancol X tác dụng với axit Y được este E. Làm bay hơi 8,6 gam E thu được thể tích hơi đúng bằng thể tích của 3,2 gam O2 (đo ở cùng điều kiện). Biết MX > MY. Công thức cấu tạo của E là
A. CH2=CHCOOC2H5. B. HCOOCH=CHCH3. C. HCOOCH2CH=CH2. D. CH2=CHCOOCH3.
D.30.
Đun 9,2 gam glixerin và 9 gam CH3COOH có xúc tác thu được m gam sản phẩm hữu cơ E chứa một loại nhóm chức. Biết hiệu suất phản ứng bằng 60%. Giá trị của m là:
A. 8,76. B. 9,64. C. 7,54. D. 6,54.
D.31.
Một dung dịch chứa 1,22g chất hữu cơ X là đồng đẳng của phenol. Cho dung dịch trên tác dụng với nước brom (dư) thu được 3,59g hợp chất Y chứa 3 nguyên tử brom trong phân tử. Biết p/ư xảy ra với hiệu suất 100%. Công thức phân tử của X là
A. C7H8O. B. C8H10O. C. C9H12O. D. C10H14O.
D.32.
Đun sôi 15,7 gam C3H7Cl với hỗn hợp KOH/C2H5OH dư, sau khi loại tạp chất và dẫn khí sinh ra qua dung dịch brom dư thấy có x gam Br2 tham gia phản ứng. Tính x nếu hiệu suất phản ứng ban đầu là 80%.
A. 25,6 gam B. 32 gam C. 16 gam D. 12,8 gam
D.33.
Cho xenlulozơ phản ứng hoàn toàn với anhiđric axetic thì sản phẩm tạo thành gồm 6,6 g CH3COOH và 11,1 g hỗn hợp X gồm xelulozơ triaxetat và xenlulozơ điaxetat. Thành phần phần trăm về khối lượng của xenlulozơ triaxetat trong hỗn hợp X là :
A. 77,84%. B. 22,16%. C. 75%. D. 25%
D.34.
Ba chất A, B, C (CxHyNz) có thành phần % về khối lượng N trong A, B, C lần lượt là 45,16%; 23, 73%; 15, 05%; A, B, C tác dụng với axit đều cho mối amoni dạng R – NH3Cl công thức của A, B, C lần lượt là:
A. CH3NH2, C3H7NH2, C4H9NH2 B. CH3NH2, C3H7NH2, C6H5NH2
C. CH3NH2, C4H9NH2, C6H5NH2 D. CH3NH2, C6H5NH2, C2H5NH2
D.35.
Khối lượng các gốc glyxyl (từ glyxin) chiếm 50% khối lượng tơ tằm (fibroin) khối lượng glyxin mà các con tằm cần có để tạo lên một kg tơ là
A. 646,55g B. 650,55g C. 649,55g D. 620,55g
D.36.
Phân tử khối gần đúng của một protein X trong lông cừu chứa 0,16% lưu huỳnh (X chỉ có 1 nguyên tử lưu huỳnh) là
A. 30.000 (đvC) B. 20.000 (đvC) C. 25.000 (đvC) D. 22.000 (đvC)
D.37.
Khi clo hóa PVC ta thu được một loại tơ clorin chứa 66% clo. Hỏi trung bình một phân tử clo tác dụng với bao nhiêu mắt xích PVC? Biết sơ đồ phản ứng như sau: (C2H3Cl)x + Cl2 à C2xH3xClx+2
A. 1 B. 2 C. 3 D. 4
D.38.
Tổng hợp 120g poli metyemetacrylat từ axit và ancol tương ứng, hiệu suất quá trình este hoá và trùng hợp lần lượt là 60% và 80%. Khối lượng của axit cần dùng là:
A. 170kg B. 175kg C. 180kg D. 182kg
Tags: Ôn Hóa














 Trang Trước
Trang Trước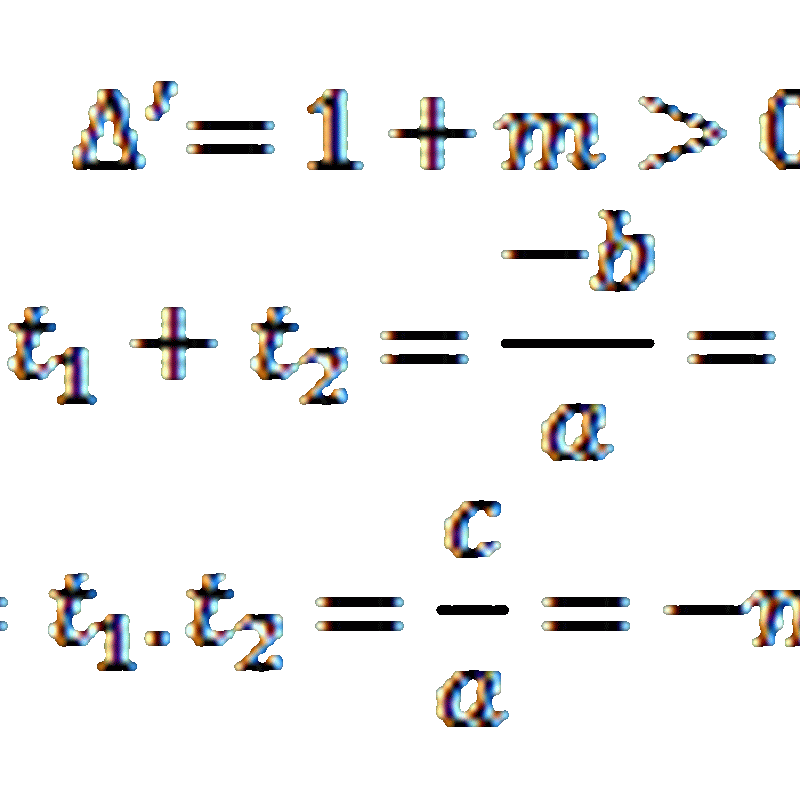







No comments: